Liens de la barre de menu commune
Fil d'Ariane
ARCHIVÉ - Conseil d'examen du prix des médicaments brevetés Canada - Rapport
 Cette page a été archivée.
Cette page a été archivée.
Information archivée dans le Web
Information archivée dans le Web à des fins de consultation, de recherche ou de tenue de documents. Cette dernière n’a aucunement été modifiée ni mise à jour depuis sa date de mise en archive. Les pages archivées dans le Web ne sont pas assujetties aux normes qui s’appliquent aux sites Web du gouvernement du Canada. Conformément à la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à la page « Contactez-nous ».
Message de la Vice-présidente
C’est avec plaisir que je vous présente le Rapport sur les plans et les priorités de 2011‑2012 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, le Conseil est investi d’un double mandat, à savoir de réglementation et de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs alors qu’au titre de son mandat de rapport, il fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement au Canada.
Le CEPMB contribue de façon importante à la santé de la population canadienne en veillant à ce que les produits médicamenteux brevetés ne soient pas vendus à des prix excessifs. Par ses études et ses analyses des tendances des prix des produits pharmaceutiques, le CEPMB contribue également à éclairer les politiques élaborées par les gouvernements fédéral et provinciaux en matière de santé.
Le CEPMB fournit au système de santé du Canada des renseignements complets sur les tendances des prix des médicaments d’ordonnance et sur les facteurs d’augmentation des coûts. Au moyen de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), le CEPMB collabore avec les intervenants fédéraux, provinciaux et territoriaux et l’Institut canadien d’information sur la santé (ICIS) afin de produire des analyses critiques des tendances des prix, de l’utilisation et des coûts des médicaments.
La capacité du CEPMB d’exécuter son mandat statutaire repose sur des lignes directrices pertinentes et efficaces sur les prix excessifs (Lignes directrices) et sur sa capacité de tenir des audiences au besoin. Les nouvelles Lignes directrices ont été adoptées en 2009, à la suite de longues consultations menées auprès de l’industrie et d’autres intervenants. En 2011‑2012, le CEPMB s’efforcera particulièrement d’évaluer l’incidence des nouvelles Lignes directrices et de faire mieux comprendre le rôle et le mandat du CEPMB aux divers intervenants.
Un cadre d’évaluation a été établi en vue de mesurer le rendement du CEPMB en fonction des résultats escomptés pour le programme. Une évaluation sera effectuée en 2011-2012 et le rapport final devrait être prêt au printemps 2012.
Il est de plus en plus difficile pour le CEPMB de répondre aux nouvelles demandes d’un milieu pharmaceutique en constante évolution et de protéger les intérêts du public en tenant des audiences sur des affaires particulières d’allégations de prix excessif. Au cours des dernières années, le nombre d’audiences tenues par le CEPMB pour déterminer si le prix d’un médicament breveté était excessif a augmenté. Un certain nombre d’affaires sont en instance, et de nouvelles audiences sur d’autres affaires devraient être tenues en 2011‑2012. Tout en évaluant l’incidence des nouvelles Lignes directrices, le CEPMB surveillera le nombre et la nature des affaires qui font l’objet d’une enquête pouvant donner lieu à une audience.
L’engagement, le dévouement et l’expertise des membres et du personnel du Conseil seront garants de sa capacité de relever ces défis avec succès, de servir les Canadiens et de contribuer à la solidité du système de soins de santé.
La version originale a été signée par
Mary Catherine Lindberg
Vice-présidente
Section 1 — Survol du Conseil
Raison d’être et Responsabilités
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets dans sa version modifiée (projet de loi C-22). La Loi a été modifiée à nouveau en 1993 (projet de loi C-91). Les révisions visaient à établir un juste équilibre entre la prolongation de la période de protection associée au brevet et la nécessité de protéger les intérêts des consommateurs en s’assurant que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs.
Le mandat du Conseil d’examen du prix des médicaments brevetés (CEPMB) comporte les deux volets suivants :
Réglementation — Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs.
Rapport — Faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la R-D au Canada.
Rôle de réglementation
Le CEPMB vérifie les prix départ-usine, à savoir les prix auxquels les brevetés vendent à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque produit médicamenteux breveté offert sur le marché canadien. C’est généralement à ce niveau que Santé Canada attribue le numéro d’identification du médicament (DIN) en vertu du processus d’attribution de l’Avis de conformité. Le mandat du Conseil couvre également les produits médicamenteux distribués au titre du Programme d’accès spécial, des produits médicamenteux distribués en vertu du programme d’essais cliniques et des drogues nouvelles de recherche. Les médicaments brevetés en vente libre et les médicaments brevetés à usage vétérinaire sont également régis par le Conseil, mais traités seulement s’ils font l’objet de plaintes.
La Cour d’appel fédérale a été appelée à déterminer les conditions où un brevet est légalement lié à un médicament. De l’avis de la Cour, pour qu’un brevet soit lié à un médicament, il doit exister entre le brevet et le médicament « un lien même ténu », ce qui sous-tend une application assez vaste de la compétence du Conseil. La compétence du Conseil s’applique aux produits médicamenteux dont le brevet porte sur son ingrédient actif, mais également aux produits médicamenteux auxquels un brevet est lié, que ce brevet vise un procédé de fabrication, un mode d’administration, une forme posologique, l’indication/utilisation, la préparation ou autre. Les produits médicamenteux brevetés ne sont pas nécessairement non plus des produits de marque. En effet, certains fabricants de produits génériques sont assujettis à la compétence du Conseil du fait qu’ils vendent en vertu d’une licence d’exploitation le même produit que le produit de marque ou, encore, qu’ils sont titulaires d’un brevet visant le procédé de conditionnement ou de traitement de produits.
Le CEPMB n’est pas habilité à réglementer les prix des produits médicamenteux non brevetés. Il n’a aucun droit de regard sur les prix de vente au gros et au détail des produits médicamenteux brevetés et non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics ou privés d’assurance-médicaments, les canaux de distribution et les habitudes d’ordonnance ne relèvent pas non plus de sa compétence.
En vertu de la Loi sur les brevets, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté sur le marché canadien. Après leur première vente, les brevetés doivent faire rapport au CEPMB du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, pour chaque semestre, ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs produits médicamenteux aux fins de l’examen et de la réglementation de leurs prix, et ce, tant qu’un brevet est lié au produit médicamenteux.
Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits médicamenteux brevetés ne soient pas jugés excessifs. Cependant, des services consultatifs sont offerts aux brevetés qui souhaitent consulter le personnel du Conseil avant de lancer un médicament breveté. Lorsqu’un produit médicamenteux breveté est vendu au Canada avant l’attribution de son brevet, l’examen de son prix est rétroactif à la date de sa première vente si celle-ci est ultérieure à la date à laquelle la demande de brevet a été rendue publique.
Lorsque, à l’issue d’une audience publique, il apparaît que le prix d’un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif.
Rapport
Chaque année, le CEPMB rend compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur l’année civile terminée, contient une analyse des tendances des prix de tous les médicaments ainsi que des dépenses de R-D des brevetés au Canada. Par ailleurs, en vertu de l’article 90 de la Loi,le ministre de la Santé a confié deux responsabilités additionnelles au CEPMB, à savoir le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) et les suivi et rapport des tendances des prix des médicaments non brevetés distribués sous ordonnance.
Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP)
Depuis 2001, en application d’une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé, le CEPMB effectue des recherches au titre du SNIUMP. Le SNIUMP a pour fonction de produire des analyses critiques des prix des médicaments distribués sous ordonnance, de l’utilisation
faite de ces médicaments et des tendances observées au niveau de leurs coûts et de présenter ses conclusions aux décideurs du régime canadien de soins de santé pour améliorer leur compréhension de la façon dont les médicaments d’ordonnance sont utilisés au Canada et des facteurs à l’origine de
l’augmentation de leurs coûts.
Prix des médicaments non brevetés distribués sous ordonnance
En 2005, intervenant aux noms des ministres F-P-T de la Santé, le ministre de Santé Canada a chargé le CEPMB d’exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Les
ministres de la Santé souhaitaient ainsi constituer une source centralisée de données fiables sur les prix de ces médicaments. Depuis avril 2008, les études sur les prix des médicaments non brevetés distribués sous ordonnance sont effectuées au titre du SNIUMP.
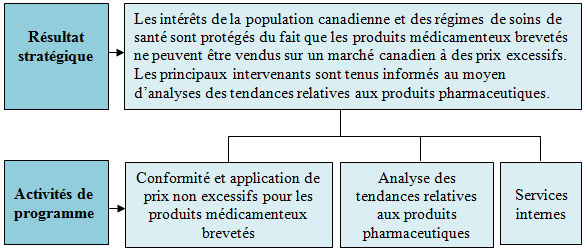
Résultat stratégique et Architecture des activités de programmes
Le CEPMB compte un résultat stratégique (RS) et trois activités de programme (AP), qui sont illustrés dans le graphique présenté ci-après.
Sommaire de la planification
| 2011-2012 | 2012-2013 | 2013-2014 |
|---|---|---|
| 11 855,0 $ | 11 855,0 $ | 11 855,0 $ |
| 2011-2012 | 2012-2013 | 2013-2014 |
|---|---|---|
| 76,0 | 76,0 | 76,0 |
Tableau de planification sommaire (en milliers de dollars)
| Indicateur de rendement | Objectif |
|---|---|
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement. | Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci. |
| Activité de programme1 | Prévision des dépenses 2010-2011 |
Dépenses prévues | Concordance avec les résultats du gouvernement du Canada | ||
|---|---|---|---|---|---|
| 2011-2012 | 2012-2013 | 2013-2014 | |||
| AP 1 : Conformité et application de prix non excessifs pour les produits médicamenteux brevetés |
5 195,2 $ | 7 464,8 $ | 7 464,8 $ | 7 464,8 $ | Des Canadiens en santé |
| AP 2 : Analyse des tendances relatives aux produits pharmaceutiques |
1 184,9 $ | 1 438,7 $ | 1 438,7 $ | 1 438,7 $ | Des Canadiens en santé |
| Total des dépenses prévues | 8 903,5 $ | 8 903,5 $ | 8 903,5 $ | ||
| Prévision des dépenses 2010-2011 |
Dépenses prévues | ||
|---|---|---|---|
| 2011-2012 | 2012-2013 | 2013-2014 | |
| 3 781,3 $ | 2 951,5 $ | 2 951,5 $ | 2 951,5 $ |
Contribution des priorités à l’atteinte du résultat stratégique
Priorités opérationnelles
| Priorités opérationnelles | ||
|---|---|---|
| Surveiller et évaluer l’incidence des nouvelles Lignes directrices | Type: Déjà établie | Liens avec l’activité de programme2 |
|
Pourquoi s’agit-il d’une priorité? Les Lignes directrices sur les prix excessifs du Conseil (Lignes directrices) visent à aider les titulaires de brevets pharmaceutiques à établir des prix non excessifs en fournissant des renseignements transparents et prévisibles sur la façon dont l’examen des prix sera effectué. Pour s’assurer que les Lignes directrices demeurent pertinentes et efficaces dans un contexte pharmaceutique moderne, le Conseil a publié les Lignes directrices révisées en juin 2009 à l’issue de longues consultations menées auprès des intervenants. Le CEPMB a élaboré un plan de surveillance et d’évaluation des Lignes directrices et rédigera son premier rapport annuel sur l’application et l’incidence des changements apportés aux Lignes directrices d’ici septembre 2011. Plans en vue de donner suite à la priorité
|
||
| Priorités opérationnelles | ||
|---|---|---|
| Sensibiliser davantage les divers intervenants au mandat et au cadre réglementaire du CEPMB et en favoriser la compréhension | Type: Nouvelle | Liens avec les activités de programme 1 et 2 |
|
Pourquoi s’agit-il d’une priorité? Pour exécuter efficacement son mandat, le CEPMB doit s’assurer que les intervenants sont informés et mobilisés. Les intervenants doivent comprendre et apprécier le rôle du CEPMB dans l’amélioration du système de soins de santé. Plans en vue de donner suite à la priorité
|
||
Priorités en matière de gestion
| Priorités en matière de gestion | ||
|---|---|---|
| Planification de la relève et gestion des connaissances | Type: Nouvelle | Liens avec les activités de programme 1, 2 et 3 |
|
Pourquoi s’agit-il d’une priorité? Le processus de planification et de gestion de la relève est une sous‑composante du processus élargi de planification intégrée des ressources humaines et des activités. Les données démographiques révèlent qu’une proportion élevée des membres du personnel plus expérimentés du CEPMB sera admissible à la retraite au cours des cinq prochaines années. Plus de 40 % ont plus de 50 ans. Les gestionnaires doivent s’assurer de procéder à la planification des ressources humaines et à la gestion des connaissances pour préparer une réserve d’employés à occuper des postes à des échelons plus élevés et à réduire au maximum la perte de mémoire de l’organisation lorsque celle‑ci fera face à ce mouvement des effectifs. Plans en vue de donner suite à la priorité
|
||
| Priorités en matière de gestion | ||
|---|---|---|
| Évaluation de programme | Type: Déjà établie | Liens avec les activités de programme 1 et 2 |
|
Pourquoi s’agit-il d’une priorité? Corrélativement à l’obtention de plus de ressources en 2008-2009 et au‑delà, le CEPMB s’est engagé à évaluer en 2011‑2012 la mesure dans laquelle l’augmentation des ressources l’a aidé à atteindre ses objectifs. Le modèle logique, la matrice d’évaluation et le cadre de mesure du rendement élaborés en 2009‑2010 et en 2010‑2011 serviront à structurer des activités d’évaluation du rendement en fonction des résultats visés. Plans en vue de donner suite à la priorité
|
||
Analyse des risques
La capacité du CEPMB à exécuter son mandat statutaire dépend principalement de sa capacité d’effectuer des examens de prix et des enquêtes et de mener des audiences, s’il y a lieu, en temps opportun. Les nouvelles Lignes directrices sur les prix excessifs adoptées en juin 2009 servent à assurer l’efficacité, l’équité, la transparence, la prévisibilité et la pertinence continues du processus d’examen des prix dans un milieu pharmaceutique en constante évolution.
Le CEPMB devrait continuer à faire face à des défis liés à l’opérationnalisation des Lignes directrices révisées, y compris la complexité accrue des examens scientifiques (attribuable à l’ajout de facteurs d’amélioration thérapeutique) et des examens des prix. Cela veut dire une charge de travail plus lourde pour le personnel du Conseil, alors qu’il doit aussi participer à un important projet de renouvellement de la technologie de l’information.
L’allocation de ressources accrues a été obtenue lorsqu’on a rajusté la mise à jour annuelle des niveaux de référence (MJANR) du CEPMB en 2009‑2010. Cependant, certains rajustements concernant l’allocation de ces ressources ont été effectués et d’autres pourraient s’ajouter étant donné la difficulté à prévoir les conséquences de l’augmentation des charges de travail qui découle des modifications apportées aux Lignes directrices et à la mise en œuvre de mesures économiques présentées dans le budget de 2010.
Surveiller et évaluer l’application et l’incidence des Lignes directrices révisées atténuera les risques pour l’organisation en permettant de relever et de résoudre rapidement les questions liées aux Lignes directrices. Le personnel du Conseil sera mieux à même de relever les défis concernant les titulaires de brevets pharmaceutiques et d’autres intervenants à mesure qu’ils se posent.
En 2011‑2012, on mettra l’accent sur l’importance des activités destinées à recueillir et à rassembler des données, conformément au cadre d’évaluation des programmes. Puisque la capacité interne de l’organisation d’évaluer les programmes est limitée, le CEPMB engagera des spécialistes externes en vue d’élaborer et de mettre en œuvre la stratégie de mesure du rendement et de procéder à l’évaluation en tant que telle. Il faut tenir compte du coût estimatif de l’évaluation, y compris la collecte de données, l’administration du matériel de collecte de données et les guides d’entrevue, de l’analyse des données et de la rédaction du rapport dans les coûts liés aux programmes. La mesure dans laquelle le CEPMB peut adopter des méthodes plus coûteuses pourrait donc être limitée. Cependant, on s’assurera que l’évaluation est adaptée à la portée du programme, à la complexité et aux risques et que le plan de mesure est réaliste, compte tenu des ressources disponibles.
Les résultats de l’évaluation pourraient influer sur la conception et l’administration du programme. Un système de suivi sera mis en place afin de donner suite aux plans d’action de la gestion découlant de l’exercice.
Profil des dépenses
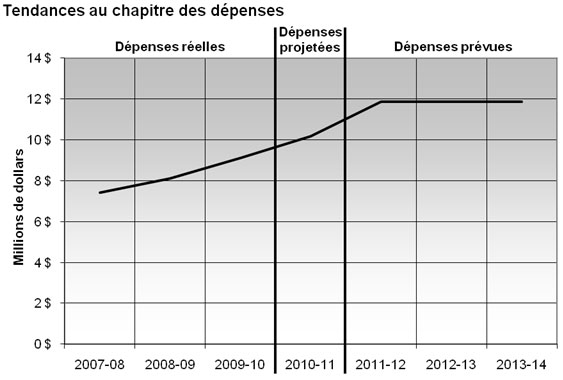
Pour reconnaître les pressions découlant de la charge de travail accrue et l’élimination progressive du financement temporaire à l’intégrité des programmes en 2008‑2009, un financement permanent de 4,7 millions de dollars s’ajoutant à des services votés de base de 5,8 millions de dollars a été accordé au CEPMB pour lui permettre de réduire les pressions découlant de la charge de travail et de poursuivre les initiatives en cours liées à l’exécution de son mandat.
Le Conseil du Trésor a approuvé la hausse des niveaux de référence au crédit 35 (Dépenses du programme) de 5,6 millions de dollars pour 2009-2010, de 6,2 millions de dollars pour 2010‑2011 et de 5,8 millions de dollars pour 2011‑2012 et les années ultérieures (dont le régime d’avantages sociaux des employés (RASE), mais excluant les frais des locaux de Travaux publics et Services gouvernementaux Canada).
Dans le cadre de cette augmentation des ressources, on a autorisé, au crédit 35 (Dépenses du programme), une hausse de l’affectation à but spécial (ABS) de 300 000 $ destinée à tenir des audiences de 1,9 million de dollars pour 2008-2009, de 2,2 millions de dollars pour 2009-2010, de 2,8 millions de dollars pour 2010-2011 et de 2,8 millions de dollars pour 2011-2012 et les années ultérieures. La capacité de tenir des audiences publiques au besoin est une composante fondamentale du mandat et des pouvoirs du Conseil. En raison de la difficulté à prévoir le nombre d’audiences et leur complexité pour une année donnée, les montants concernant les coûts externes des audiences (conseiller juridique, témoins experts, etc.) sont inscrits dans l’ABS afin qu’ils soient strictement réservés à cette fin. Tout montant non dépensé à la fin de l’année est retourné au Trésor. Cette mesure sert à s’assurer que le CEPMB dispose des ressources nécessaires pour tenir des audiences même pendant les années les plus exceptionnelles.
Bien que les dépenses (réelles) aient augmenté chaque année de 2007‑2008 à 2009‑2010, on a tenu moins d’audiences que prévu. La présentation d’engagements de conformité volontaire (ECV) a permis de régler quelques cas. De plus, la dotation de certains nouveaux postes a posé un problème. Le CEPMB s’attend à déclarer des dépenses de 10,2 millions de dollars sur un niveau de référence final prévu de 12,8 millions de dollars pour 2010‑2011.
Budget des dépenses par crédit voté
Pour obtenir plus de renseignements sur nos crédits organisationnels et/ou dépenses législatives, veuillez consulter le Budget principal des dépenses 2011‑2012. Vous trouverez une version électronique du budget principal des dépenses sur le site http://www.tbs-sct.gc.ca/est-pre/20112012/me-bpd/toc-tdm-fra.asp.
