Liens de la barre de menu commune
Fil d'Ariane
ARCHIVÉ - Conseil d’examen du prix des médicaments brevetés - Rapport
 Cette page a été archivée.
Cette page a été archivée.
Information archivée dans le Web
Information archivée dans le Web à des fins de consultation, de recherche ou de tenue de documents. Cette dernière n’a aucunement été modifiée ni mise à jour depuis sa date de mise en archive. Les pages archivées dans le Web ne sont pas assujetties aux normes qui s’appliquent aux sites Web du gouvernement du Canada. Conformément à la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à la page « Contactez-nous ».
Message de la présidente
J’ai le plaisir de présenter le Rapport sur les plans et les priorités 2012‑2013 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est déterminé à exécuter son mandat avec équité et transparence. En 2011, nous nous sommes concentrés sur une évaluation de nos orientations à la lumière des virages en cours dans le milieu des soins de santé. Nous observons d’importants changements, tant à l’échelle nationale qu’internationale, alors que les pratiques de distribution évoluent, que les modèles de vente changent, que les brevetés offrent différents types de programmes de prestations et que de nouveaux types de médicaments continuent d’être mis sur le marché.
L’objectif du CEPMB de s’assurer que les Canadiens ne paient pas un prix trop élevé pour des médicaments brevetés est d’une grande importance, car il s’inscrit dans l’atteinte du but pangouvernemental visant la santé des Canadiens. Il a une incidence sur les payeurs publics et privés et sur les clients qui assument eux‑mêmes ces coûts. La décision du 20 janvier 2011 de la Cour suprême du Canada confirmant certains aspects clés de la compétence du Conseil a fourni une précision importante et une confirmation du rôle du CEPMB concernant la protection des consommateurs. À cette fin, nous avons modifié notre politique en matière d’engagement auprès des intervenants et renforcé notre liaison auprès des brevetés. Notre Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices permet d’ouvrir un dialogue permanent avec les intervenants et d'apporter des modifications à nos Lignes directrices en temps opportun. Nous entendons modifier les Lignes directrices de sorte qu’elles tiennent compte de l’évolution de l’environnement lié à la distribution des médicaments et à la conjoncture des prix, et ce, selon un calendrier convenable.
Au cours de la prochaine année, nos priorités consistent à améliorer la conformité en examinant des modes de règlement extrajudiciaire des différends, à étudier des moyens possibles d’alléger le fardeau de la réglementation pour les brevetés et à utiliser nos ressources de la façon la plus efficace possible, tout en étant ouverts et transparents. Notre engagement renforcé auprès des intervenants nous aidera aussi beaucoup à respecter notre engagement de longue date à maintenir un régime de réglementation pertinent, adapté et approprié.
Nous ne perdons pas de vue notre rôle en matière d’établissement de rapports. Dans le cadre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), nous poursuivons notre partenariat avec l’Institut canadien d’information sur la santé, Santé Canada, les provinces et les territoires. Nous avons publié plusieurs rapports au cours de l’année qui vient de s’écouler et avons entamé un certain nombre d’études qui fourniront aux décideurs et aux gestionnaires de régimes d’assurance‑médicaments des renseignements et des observations sur les tendances relatives aux prix, à l’utilisation et aux coûts des médicaments.
En qualité de présidente du CEPMB, j’ai pour objectif de m’assurer que notre cadre continue d’avoir une incidence favorable pour les consommateurs, tout en reconnaissant l’intérêt qu’offrent les médicaments innovants pour les patients. Le CEPMB maintient son engagement à relever les défis avec efficacité, à servir les Canadiens et à collaborer au système de soins de santé.
Mary Catherine Lindberg
Présidente
Section I : Survol de l’organisation
Raison d’être
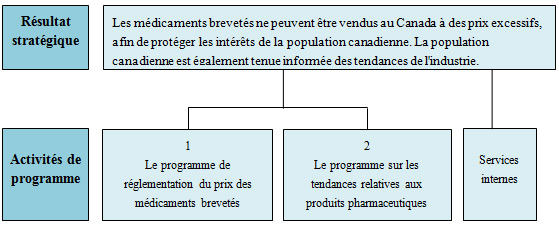
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant quasi judiciaire créé par le Parlement en 1987. Le CEPMB est investi d'un double rôle :
- le premier concerne la réglementation et consiste à s'assurer que les prix auxquels les brevetés vendent leurs médicaments brevetés ne sont pas excessifs;
- le second consiste à faire rapports des tendances des prix de vente de tous les médicaments, ainsi que des dépenses de brevetés en matière de recherche et de développement.
Dans l'exécution de son mandat, le CEPMB s'efforce de s'assurer que les Canadiens n'ont pas à débourser des sommes excessives pour l'achat de médicaments brevetés au Canada, et que les intervenants sont tenus informés sur les tendances relatives aux produits pharmaceutiques.
Responsabilités
Le CEPMB a été créé en vertu de la Loi sur les brevets dans sa version modifiée (projet de loi C-22). La Loi a été modifiée à nouveau en 1993 (projet de loi C-91). Les révisions visaient à établir un juste équilibre entre la prolongation de la période de protection associée au brevet et la nécessité de protéger les intérêts des consommateurs en s’assurant que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs.
Rôle de réglementation
Le CEPMB vérifie les prix départ-usine, à savoir les prix auxquels les brevetés vendent à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs médicaments brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre au Canada et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien. C’est généralement à ce niveau que Santé Canada attribue le numéro d’identification du médicament (DIN) en vertu du processus d’attribution de l’Avis de conformité. Le mandat du Conseil couvre également les médicaments distribués au titre du Programme d’accès spécial, des médicaments distribués en vertu du programme d’essais cliniques et des drogues nouvelles de recherche. Les médicaments brevetés en vente libre et les médicaments brevetés à usage vétérinaire sont également régis par le Conseil, mais traités seulement s’ils font l’objet de plaintes.
La Cour d’appel fédérale a été appelée à déterminer les conditions où un brevet est légalement « lié » à un médicament. De l’avis de la Cour, pour qu’un brevet soit lié à un médicament, il doit exister entre le brevet et le médicament « un lien même ténu », ce qui sous-tend une application assez vaste de la compétence du Conseil. La compétence du Conseil s’applique aux médicaments dont le brevet porte sur son ingrédient actif, mais également aux médicaments auxquels un brevet est lié, que ce brevet vise un procédé de fabrication, un mode d’administration, une forme posologique, l’indication/utilisation, la préparation ou autre. Les médicaments brevetés ne sont pas nécessairement non plus des médicaments de marque. En effet, certains fabricants de médicaments génériques sont assujettis à la compétence du Conseil du fait qu’ils vendent en vertu d’une licence d’exploitation le même médicament que le médicament de marque ou, encore, qu’ils sont titulaires d’un brevet visant le procédé de conditionnement ou de traitement de médicament.
Le CEPMB n’est pas habilité à réglementer les prix des médicaments non brevetés. Il n’a aucun droit de regard sur les prix de vente au gros et au détail des médicaments brevetés et non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics ou privés d’assurance-médicaments, les canaux de distribution et les habitudes d’ordonnance ne relèvent pas non plus de sa compétence.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau médicament breveté. Après leur première vente, les brevetés doivent faire rapport au CEPMB du prix de vente de leur médicament et de la quantité vendue, conformément au Règlement sur les médicaments brevetés. Par la suite, pour chaque semestre (de janvier à juin et de juillet à décembre), ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs médicaments aux fins de l’examen et de la réglementation de leurs prix, et ce, tant qu’un brevet est lié au médicament.
Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs médicaments, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs médicaments brevetés ne soient pas jugés excessifs. Cependant, des services consultatifs sont offerts aux brevetés qui souhaitent consulter le personnel du Conseil avant de lancer un médicament breveté. Lorsqu’un médicament breveté est vendu au Canada avant l’attribution de son brevet, l’examen de son prix est rétroactif à la date de sa première vente si celle-ci est ultérieure à la date à laquelle la demande de brevet a été rendue publique.
Lorsque, à l’issue d’une audience publique, il apparaît que le prix d’un médicament vendu sur un marché canadien est ou était excessif, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif.
Rapport
Chaque année, le CEPMB rend compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur une année civile, comprend un examen des principales activités du CEPMB, une analyse des prix des médicaments brevetés et des tendances observées au niveau des prix de tous les médicaments, ainsi que des dépenses de recherche et développement (R‑D) déclarées par les fabricants de médicaments qui sont titulaires de brevets. Le CEPMB rend également compte de ses activités dans son bulletin trimestriel La Nouvelle et diverses études.
En vertu d’une entente conclue par les ministres fédéral, provinciaux et territoriaux (FPT) de la Santé, ainsi qu’à la demande expresse du ministre fédéral de la Santé, le CEPMB s’est associé à l’Institut canadien d’information sur la santé Canadian (ICIS) dans le cadre de l’initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Selon cette initiative, le CEPMB présente des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments au Canada, afin d’appuyer la prise de décisions stratégiques des gouvernements fédéral, provinciaux et territoriaux en matière d’assurance‑médicaments. En 2005, le ministre fédéral de la Santé, agissant au nom des ministres FPT de la Santé, a demandé au CEPMB d’assurer le suivi des prix des médicaments d’ordonnance non brevetés. Depuis 2008, ce travail est effectué dans le cadre de l’initiative du SNIUMP.
Résultats stratégiques et Architecture des activités de programme
Priorités organisationnelles
| Priorité | Type1 | Résultats stratégiques et/ou activités de programmes 2 |
|---|---|---|
| Amélioration de la conformité avec les Lignes directrices du Conseil | Nouvelle | Liens avec les activités de programme 1 |
| Description | ||
|
Pourquoi s’agit-il d’une priorité? En juin 2009, à l’issue de consultations approfondies avec ses intervenants clés, le Conseil a revu ses Lignes directrices, et le nouveau Compendium des politiques, des Lignes directrices et des procédures est entré en vigueur le 1er juin 2010. Les Lignes directrices révisées ont pour objectif d’aider les brevetés pharmaceutiques à établir des prix non excessifs, et ce, en leur fournissant des renseignements transparents et prévisibles sur la conduite de l’examen des prix. La conformité accrue aux Lignes directrices permettra d’assurer la protection des Canadiens contre les prix excessifs des médicaments brevetés vendus au Canada. Le CEPMB a également élaboré un Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices et, en 2011‑2012, il a effectué sa première évaluation annuelle de l’application et de l’incidence des modifications aux Lignes directrices. Bien que plusieurs périodes de référence puissent s’avérer nécessaires pour discerner clairement des tendances, le Conseil surveillera les questions émergentes afin de cerner les modifications à apporter éventuellement aux Lignes directrices ou au Plan de surveillance et d’évaluation. Plans en vue de donner suite à la priorité
|
||
| Priorité | Type | Résultats stratégiques et/ou activités de programmes |
|---|---|---|
| Réduction du fardeau réglementaire et utilisation efficace des ressources du personnel du Conseil | Nouvelle | Liens avec les activités de programme 1 et 2 |
| Description | ||
|
Pourquoi s’agit-il d’une priorité? En janvier 2011, le premier ministre a lancé la Commission sur la réduction de la paperasse (CRP) dans le cadre du Plan d’action économique. La Commission a été invitée à cerner les irritants pour les entreprises, dont les effets sont manifestement néfastes pour la croissance, la concurrence et l’innovation, et à recommander des moyens de s’y attaquer et de réduire le fardeau lié à la conformité de façon durable, tout cela devant être assuré sans compromettre la protection de l’environnement ou la santé et la sécurité des Canadiens. Il a été établi ultérieurement que les irritants désignés par l’industrie ne relevaient pas de la portée de cette initiative et qu’ils ne figuraient pas dans le rapport de la Commission. Le CEPMB espère néanmoins renforcer l’esprit de cette initiative en revoyant son processus d’examen des prix, afin de cerner des moyens possibles de réduire le fardeau réglementaire imposé aux brevetés, sans porter atteinte à son mandat de protection des consommateurs. Par ailleurs, en conséquence des mesures de compression des dépenses prévues dans le budget de 2010, dans le cadre desquelles les budgets de fonctionnement des ministères ont été gelés à leurs niveaux de 2010‑2011, le CEPMB a désigné des postes qui vont demeurer vacants. Il a ainsi mis en place une certaine efficacité opérationnelle qui pourra éventuellement être améliorée, afin d’assurer l’utilisation optimale des ressources. Plans en vue de donner suite à la priorité
|
||
| Priorité | Type | Résultats stratégiques et/ou activités de programmes |
|---|---|---|
| Transparence et communications | Nouvelle | Liens avec les activités de programme 1 et 2 |
| Description | ||
|
Pourquoi s’agit-il d’une priorité? Cette initiative a pour but de sensibiliser l’ensemble des intervenants aux services et aux renseignements qu’offre le CEPMB. Afin d’exécuter son mandat avec efficacité, le CEPMB doit s’assurer que les intervenants sont à la fois renseignés et mobilisés. Ils doivent comprendre et apprécier le rôle du CEPMB à titre de collaborateur du système de soins de santé. Plans en vue de donner suite à la priorité
|
||
Analyse des risques
Le CEPMB doit s’assurer que les prix (« prix départ usine ») auxquels les brevetés vendent les médicaments brevetés au Canada, pour usage humain ou usage vétérinaire, ne sont pas excessifs. Comme beaucoup d’organismes de réglementation, le CEPMB prône la conformité volontaire et s’appuie sur elle, parce qu’il s’agit d’un moyen d’utiliser efficacement les ressources et de contrôler ses dépenses, de même que celles des brevetés. De plus, la conformité volontaire constitue souvent le moyen le plus opportun de s’assurer que les consommateurs et les payeurs canadiens bénéficient de la vente des médicaments brevetés à des prix non excessifs. Le CEPMB a largement réussi à exécuter son mandat en tenant un nombre restreint d’audiences publiques, ce qui est attribuable, au moins en partie, au taux de conformité à ses Lignes directrices sur les prix excessifs (les Lignes directrices) et à l’utilisation des engagements de conformité volontaire, lesquels sont intégrés à sa politique de conformité volontaire.
Pendant près de cinq ans, le Conseil a procédé à un examen complet de ses Lignes directrices et, en janvier 2010, ses Lignes directrices révisées sont entrées en vigueur. Les nouvelles Lignes directrices sur les prix excessifs adoptées en juin 2009 servent à assurer l’efficacité, l’équité, la transparence, la prévisibilité et la pertinence continues du processus d’examen des prix dans un milieu pharmaceutique en constante évolution. Deux modifications importantes visaient plus particulièrement à surmonter les obstacles liés aux éléments suivants : a) l’innovation cumulative et b) la pratique des brevetés consistant à offrir des avantages aux consommateurs et aux payeurs dans le cadre de leurs modèles d’affaires et de distribution. D’après les premières indications, les deux modifications ont renforcé la conformité et ont aidé à gérer les ressources du CEPMB de façon efficace. En réponse aux difficultés qu’il a éprouvées en mettant en œuvre les nouvelles Lignes directrices, le Conseil n’a pas tardé à clarifier l’interprétation et l’application de ses Lignes directrices, ainsi qu’à adopter des approches visant à faciliter la mise en œuvre efficace des nouveaux éléments.
En 2011‑2012, le CEPMB a approuvé un Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices. La surveillance et l’évaluation de l’application et de l’incidence des Lignes directrices révisées atténueront les risques pour l’organisation, en permettant de cerner et de résoudre rapidement les problèmes liés aux Lignes directrices. Le personnel du Conseil pourra ainsi s’attaquer plus efficacement aux difficultés que rencontrent les brevetés pharmaceutiques et d’autres intervenants au fur et à mesure qu’elles se posent.
La capacité du CEPMB de s’acquitter de son mandat de réglementation est axée sur sa capacité de mener des examens des prix et des enquêtes en temps opportun et, au besoin, de tenir des audiences. De façon générale, les brevetés respectent la Loi sur les brevets et les Lignes directrices du Conseil en s’abstenant de pratiquer des prix excessifs (le taux de conformité est d’environ 90 %). En 2012‑2013, afin de maintenir ce niveau et de favoriser une conformité accrue, le CEPMB a établi les deux priorités suivantes : a) examiner des modes substitutifs de règlement des différends et b) analyser à fond des moyens de réduire le fardeau réglementaire imposé aux brevetés et d’utiliser de façon optimale les ressources en personnel.
Au Canada, le contexte de l’établissement des prix et du remboursement évolue au fil du temps et s’est passablement transformé au cours de l’année qui vient de s’écouler. En outre, les ventes de médicaments brevetés, ainsi que la nature et la distribution de ces médicaments, évoluent aussi dans des secteurs qui gagnent en complexité et en innovation. Pour le CEPMB, la difficulté consiste à continuer de s’acquitter de son mandat avec efficacité face à l’évolution du contexte, et à y parvenir dans les limites d’une prudence financière croissante. Le risque d’échec dans l’exécution de cette tâche et la conséquence d’un pareil échec auraient un effet néfaste sur le cadre de l’établissement des prix des médicaments brevetés au Canada. Pour les payeurs, la hausse des coûts serait importante.
À l’échelle internationale, on constate également que des changements sont apportés à l’établissement des prix et au remboursement des médicaments brevetés. Au cours des prochaines années, on peut s’attendre à une chute des prix des médicaments brevetés, notamment en Allemagne et au Royaume‑Uni. Étant donné qu’il s’agit de deux pays de comparaison aux fins de l’examen des prix du CEPMB, les changements qu’ils apporteront à leur politique et aux prix feront l’objet d’une étroite surveillance. De plus, le CEPMB continuera de surveiller les négociations commerciales internationales qui pourraient comprendre une clause de propriété intellectuelle (p. ex., les négociations actuelles entre l’Union européenne et le Canada), afin de cerner leur incidence potentielle sur son cadre législatif et réglementaire. Les priorités du CEPMB pour 2012‑2013 peuvent nécessiter un ajustement en cas de modifications importantes des politiques ou des lois à l’échelle nationale ou internationale.
En 2011‑2012, le CEPMB a retenu les services de spécialistes externes aux fins d’évaluation de ses programmes. Les conclusions de l’évaluation, qui devraient être mises au point au printemps 2012, pourront influer sur la conception et l’administration des programmes. En outre, les résultats de l’évaluation des programmes pourraient exiger des modifications aux Lignes directrices. En 2012‑2013, un plan d’action de gestion sera élaboré et adopté, et un système de suivi permettra d’assurer la mise en œuvre des éléments du plan au fil du temps.
Comme le Conseil a cerné le besoin de s’adapter au contexte en évolution, il continue de se concentrer sur la transparence et les communications. À titre d’exemple, le Conseil continue d’affecter des fonds à la tenue de séances de liaison auprès des brevetés, ainsi qu’à la bonification de l’accessibilité et de l’utilité du matériel affiché sur son site Web. Le Conseil continue de communiquer régulièrement avec les brevetés et d’autres intervenants par le truchement de divers moyens et forums. Dans le cadre de son programme sur les tendances relatives aux prix des produits pharmaceutiques, le CEPMB analyse les tendances relatives aux prix des produits pharmaceutiques, ainsi que les dépenses de recherche et développement effectuées par les brevetés pharmaceutiques. Il présente des analyses critiques des tendances relatives aux prix, à l’utilisation et aux coûts des médicaments d’ordonnance, de même que des renseignements sur les prix des médicaments d’ordonnance non brevetés. Pour le CEPMB, la difficulté consiste à s’assurer que ses rapports fournissent des renseignements pertinents et qu’ils sont publiés en temps utile, de façon à procurer des renseignements crédibles sur les tendances relatives aux prix des produits pharmaceutiques et de répondre aux besoins d’information de divers décideurs politiques.
Nous prévoyons que la charge de travail demeurera relativement stable au cours de la prochaine année, tandis que les ressources du Conseil pourraient être remises en de l’évolution du profil des ressources humaines, compte tenu de l’admissibilité à la retraite et de l’évolution démographique de la main‑d’œuvre. La haute direction du CEPMB a adopté un plan de relève qui permettra de surmonter ces difficultés. Le CEPMB continue par ailleurs d’utiliser un modèle de planification intégrée des ressources humaines et des activités.
Sommaire – Rendement
Ressources financières (en milliers de dollars)
| 2012-2013 | 2013-2014 | 2014-2015 |
|---|---|---|
| 11 832,4 | 11 832,4 | 11 832,4 |
Ressources humaines (équivalent temps plein – ETP)
| 2012-2013 | 2013-2014 | 2014-2015 |
|---|---|---|
| 76,0 | 76,0 | 76,0 |
| Indicateurs de rendement | Cibles |
|---|---|
| Au Canada les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison énumérés dans le Règlement | Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci |
| Activité de programme | Prévision des dépenses 2011-2012 | Dépenses prévues | Concordance avec les résultats du gouvernement du Canada | ||
|---|---|---|---|---|---|
| 2012-2013 | 2013-2014 | 2014-2015 | |||
| AP 1 : Le programme de réglementation du prix des médicaments brevetés | 5 078,8 | 7 508,1 | 7 508,1 | 7 508,1 | Des Canadiens en santé |
| AP 2 : Le programme sur les tendances relatives aux produits pharmaceutiques | 919,6 | 1 265,4 | 1 265,4 | 1 265,4 | Des Canadiens en santé |
| Total des dépenses prévues | 8 773,5 | 8 773,5 | 8 773,5 | ||
| Activité de programme | Prévision des dépenses 2011-2012 | Dépenses prévues | ||
|---|---|---|---|---|
| 2012-2013 | 2013-2014 | 2014-2015 | ||
| Services internes | 3 447,0 | 3 058,9 | 3 058,9 | 3 058,9 |
| Total des dépenses prévues | 11 832,4 | 11 832,4 | 11 832,4 | |
Profil des dépenses
Tendances au chapitre des dépenses ministérielles
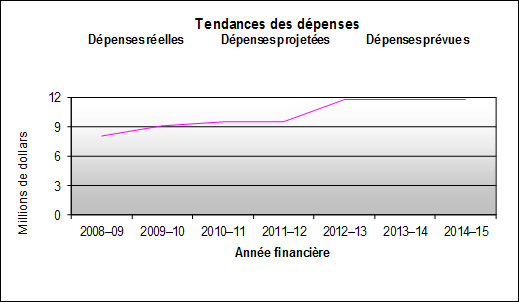
Pour reconnaître les pressions découlant de la charge de travail accrue et l’élimination progressive du financement temporaire à l’intégrité des programmes en 2008‑2009, un financement permanent de 5,1 millions de dollars, y compris le régime d’avantages sociaux des employés (RASE), mais excluant les frais des locaux de Travaux publics et Services gouvernementaux Canada, s’ajoutant à des services votés de base de 5,8 millions de dollars, a été accordé au CEPMB pour lui permettre de réduire les pressions découlant de la charge de travail et de poursuivre les initiatives en cours liées à l’exécution de son mandat. Le Conseil du Trésor a également approuvé la hausse des niveaux de référence au crédit 35 (Dépenses du programme) de 5,6 millions de dollars pour 2009-2010, de 6,2 millions de dollars pour 2010‑2011 et de 5,8 millions de dollars pour 2011‑2012 et les années ultérieures (y compris le régime d’avantages sociaux des employés (RASE), mais excluant les frais des locaux de Travaux publics et Services gouvernementaux Canada).
Dans le cadre de cette augmentation des ressources, on a autorisé 1,9 millions de dollars en 2008-2009, 2,2 millions de dollars en 2009-2010 et 2,8 millions de dollars en 2010-2011 et pour les années ultérieures aux fins de l’affectation à but spécial (ABS) destinée à tenir des audiences publiques. Le financement permanent total de l’ABS a donc augmenté à 3,1 millions de dollars. L’ABS ne peut être utilisé que pour couvrir les coûts relatifs aux audiences, tels que les conseillers juridiques externes, les témoins experts, etc. Tout montant non dépensé est retourné au Trésor.
En raison de difficultés relatives au recrutement de nouveau personnel et d’un faible nombre de journées réservées aux audiences, le CEPMB n’a pas dépensé le montant total de son budget au cours de la période de 2008-2009 à 2010-2011. Le CEPMB a maintenant achevé la dotation de tous les postes prévus et il prévoit que ses dépenses réelles (sauf l’ABS) refléteront le financement accordé.
En ce qui concerne l’ABS, les dépenses engagées pour les services tels que les conseillers juridiques externes et les témoins experts dépendent entièrement sur le nombre d’audiences tenues ainsi que sur la durée et la complexité des audiences. Par conséquent, il est très difficile d’en prévoir le montant. Les fonds provenant de l’ABS qui ne sont pas requis pour des audiences seront retournés au Trésor. Suite aux mesures de limitation des coûts prévues au budget fédéral de 2010, les budgets opérationnels des ministères ont été gelés aux niveaux de 2010-2011.
Budget des dépenses par crédit voté
Pour obtenir plus de renseignements sur nos crédits organisationnels, veuillez consulter le Budget principal des dépenses 2012-2013.
