ARCHIVÉ - Conseil d'examen du prix des médicaments brevetés Canada
 Cette page a été archivée.
Cette page a été archivée.
Information archivée dans le Web
Information archivée dans le Web à des fins de consultation, de recherche ou de tenue de documents. Cette dernière n’a aucunement été modifiée ni mise à jour depuis sa date de mise en archive. Les pages archivées dans le Web ne sont pas assujetties aux normes qui s’appliquent aux sites Web du gouvernement du Canada. Conformément à la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à la page « Contactez-nous ».
2010-2011
Rapport sur les plans et les priorités
Conseil d'examen du prix des médicaments brevetés Canada
La version originale a été signée par
L'honorable Leona Aglukkaq
Ministre de la Santé
Table des matières
- Raison d'être et responsabilités
- Résultat stratégique et Architecture des activités de programme
- Sommaire de la planification
- Analyse des risques
- Profil des dépenses
- Crédits votés et postes législatifs
Section II — Analyse des activités de programme par résultat stratégique
Section III — Renseignements supplémentaires
Message du Président
C'est avec plaisir que je vous présente le Rapport sur les plans et les priorités de 2010-2011 du Conseil d'examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, le Conseil est investi d'un double mandat, à savoir de réglementation et de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs alors qu'au titre de son mandat de rapport, il fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement au Canada.
Le CEPMB contribue également à l'amélioration de la condition de santé de la population canadienne en protégeant les intérêts des consommateurs et du régime canadien de soins de santé, et ce, en veillant à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs.
Le 9 juin 2009, après avoir mené une vaste consultation auprès de ses principaux intervenants comme l'exige la Loi sur les brevets, le CEPMB a publié ses nouvelles Lignes directrices sur les prix excessifs avec entrée en vigueur le 1er janvier 2010. L'application des nouvelles Lignes directrices et l'incidence des changements apportés feront l'objet d'un suivi attentif au cours de l'exercice 2010-2011 et suivants.
Au cours des dernières années, le CEPMB a connu une augmentation marquée du nombre d'audiences dont l'objet est de déterminer si le prix d'un produit médicamenteux breveté est ou non excessif. Certaines audiences ont été closes au cours de l'exercice 2009-2010, mais plusieurs autres sont en cours et de nouvelles devraient s'ajouter.
Dans le cadre de son processus de mise en œuvre de ses nouvelles Lignes directrices, le CEPMB continuera de bien informer ses intervenants, dont les brevetés. Il mettra en place des processus de simplification des examens du prix et des enquêtes. Le Conseil révisera également ses règles de conduite des audiences aux fins d'accélérer le processus d'audience et de le rendre encore plus efficient.
Chaque année, par l'intermédiaire du ministre de la Santé, le CEPMB fait rapport au Parlement de ses activités, des tendances des prix des produits pharmaceutiques brevetés et des dépenses des brevetés dans la recherche-développement au Canada. Le CEPMB continuera de travailler en collaboration avec l'Institut canadien de la santé (ICIS) et avec les régimes F-P-T d'assurance-médicaments au niveau de la production d'analyses et de rapports au titre du Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). Au moyen d'analyses des tendances des prix, de l'utilisation faite des produits médicamenteux et des coûts, le CEPMB fournit au régime canadien de soins de santé des renseignements récents, complets et fiables sur les tendances des médicaments d'ordonnance ainsi que sur les facteurs d'augmentation des coûts.
Enfin, le CEPMB ne ménage aucun effort pour exercer son mandat de réglementation et de rapport d'une manière prévisible, juste et transparente, pour poursuivre son engagement auprès de ses intervenants, ainsi que pour exercer un suivi vigilant de l'évolution de l'environnement pharmaceutique.
La version originale a été signée par
Brien G. Benoit, MD
Président du Conseil
Section I — Survol du Conseil
Raison d'être et responsabilités
Le Conseil d'examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets dans sa version modifiée (projet de loi C-22). La Loi a été modifiée à nouveau en 1993 (projet de loi C-91). Les révisions visaient à établir un juste équilibre entre la prolongation de la période de protection associée au brevet et le besoin de protéger les intérêts des consommateurs en s'assurant que les médicaments brevetés ne soient pas vendus à des prix excessifs.
Le mandat du Conseil d'examen du prix des médicaments brevetés (CEPMB) comporte les deux volets suivants :
Réglementation — Veiller à ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs.
Rapport — Faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la R-D au Canada.
Rôle de réglementation
Le CEPMB vérifie les prix départ-usine, à savoir les prix auxquels les brevetés vendent à leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque produit médicamenteux breveté offert sur le marché canadien. C'est généralement à ce niveau que Santé Canada attribue le numéro d'identification de drogue (DIN) en vertu du processus d'attribution de l'Avis de conformité. Le mandat du Conseil couvre également les produits médicamenteux distribués au titre du Programme d'accès spécial, des produits médicamenteux distribués en vertu du programme d'essais cliniques et des drogues nouvelles de recherche.
La Cour d'appel fédérale a été appelé à déterminer les conditions où un brevet est légalement lié à un médicament. De l'avis de la Cour, pour qu'un brevet soit lié à un médicament, il doit exister entre le brevet et le médicament « un lien si tenu soit-il », ce qui sous-tend une application assez vaste de la compétence du Conseil. La compétence du Conseil s'applique aux produits médicamenteux dont le brevet porte sur son ingrédient actif, mais également aux produits médicamenteux auxquels un brevet est lié, que ce brevet vise un procédé de fabrication, un mode d'administration, une forme posologique, l'indication/utilisation, la préparation ou autre. Les produits médicamenteux brevetés ne sont pas nécessairement non plus des produits de marque. En effet, certains fabricants de produits génériques sont assujettis à la compétence du Conseil du fait qu'ils vendent en vertu d'une licence d'exploitation le même produit que le produit de marque ou, encore, qu'ils sont titulaires d'un brevet visant le procédé de conditionnement ou de traitement de produits.
Le CEPMB n'est pas habilité à réglementer les prix des produits médicamenteux non brevetés. Il n'a aucun droit de regard sur les prix de vente au gros et au détail des produits médicamenteux brevetés et non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics d'assurance-médicaments, les canaux de distribution et les habitudes d'ordonnance ne relèvent pas non plus de sa compétence.
En vertu de la Loi sur les brevets, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté sur le marché canadien. Après leur première vente, les brevetés doivent faire rapport au CEPMB du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, pour chaque semestre, ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs produits médicamenteux aux fins de l'examen et de la réglementation de leurs prix et ce, tant qu'un brevet est lié au produit médicamenteux.
Même s'ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits médicamenteux brevetés ne soient pas excessifs. Lorsqu'un produit médicamenteux breveté est vendu au Canada avant l'attribution de son brevet, l'examen de son prix est rétroactif à la date de sa première vente si celle-ci est ultérieure à la date à laquelle la demande de brevet a été rendue publique.
Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance qui oblige le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives encaissées de la vente de son médicament à un prix excessif.
Rapport
Chaque année, le CEPMB rend compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur l'année civile terminée, présente également une analyse des tendances des prix de tous les médicaments et fait rapport des dépenses de R-D des brevetés au Canada. Par ailleurs, en vertu de l'article 90 de la Loi,le ministre de la Santé a confié deux responsabilités additionnelles au CEPMB, à savoir le Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP) et les suivi et rapport des tendances des prix des médicaments non brevetés distribués sous ordonnance.
Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP)
Depuis 2001, en vertu d'une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé, le CEPMB effectue des recherches au titre du SNIUMP. Le SNIUMP a pour fonction de produire des analyses critiques des prix des médicaments distribués sous ordonnance, de l'utilisation faite de ces médicaments et des tendances observées au niveau de leurs coûts et d'en soumettre les conclusions au régime canadien de soins de santé pour améliorer sa compréhension de la façon dont les médicaments d'ordonnance sont utilisés au Canada et des facteurs à l'origine de l'augmentation de leurs coûts.
Prix des médicaments non brevetés distribués sous ordonnance
En 2005, intervenant aux noms des ministres F-P-T de la Santé, le ministre de Santé Canada a chargé le CEPMB d'exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Les ministres de la Santé souhaitaient ainsi constituer une source centralisée de données fiables sur les prix de ces médicaments. Depuis avril 2008, les études sur les prix des médicaments non brevetés distribués sous ordonnance sont effectuées au titre du SNIUMP.
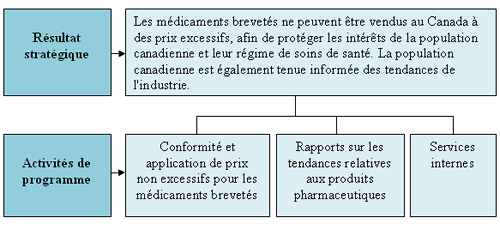
Résultat stratégique et Architecture des activités de programme
Le CEPMB compte un résultat stratégique (RS) et deux activités de programme (AP) — à savoir la réglementation et les rapports. Ce résultat et ces activités sont illustrés dans le graphique présenté ci-après.
Sommaire de la planification
| 2010-2011 | 2011-2012 | 2012-2013 |
|---|---|---|
| 12 181,6 $ | 11 816,2 $ | 11 816,2 $ |
| 2010-2011 | 2011-2012 | 2012-2013 |
|---|---|---|
| 761 | 76 | 76 |
Tableau de planification sommaire (en milliers de dollars)
| Indicateur de rendement | Objectif |
|---|---|
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement. | Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci. |
| Activité de programme2 | Prévision des dépenses 2009-2010 | Dépenses prévues | Concordance avec les résultats du gouvernement du Canada | ||
|---|---|---|---|---|---|
| 2010-2011 | 2011-2012 | 2012-2013 | |||
AP 1 : |
5 572,7 $ | 7 648,8 $ | 7 654,3 $ | 7 654,3 $ | Des Canadiens en santé |
AP 2 : |
992,5 $ | 1 624,8 $ | 1 626,6 $ | 1 626,6 $ | Des Canadiens en santé |
AP 3 : |
3 333,6 $ | 2 908,0 $ | 2 535,3 $ | 2 535,3 $ | |
| Total des dépenses CEPMB | 9 898,8 $ | 12 181,6 $ | 11 816,2 $ | 11 816,2 $ | |
Contribution des priorités à l'atteinte du résultat stratégique
Priorités opérationnelles
| Priorité opérationnelle | ||
|---|---|---|
| Veiller à la bonne application des Lignes directrices révisées sur les prix excessifs (Lignes directrices), des politiques et des procédures puis en assurer le suivi. | Type: Nouvelle | Liens avec l'activité de programme 13 |
Pourquoi s'agit-il d'une priorité? Le CEPMB a pour mandat de veiller à ce que les brevetés ne vendent pas leurs produits médicamenteux brevetés pour usage humain et pour usage vétérinaire à des prix (prix départ-usine) excessifs. À cette fin, le CEPMB compte sur la conformité volontaire des brevetés, une avenue qui pour les différentes parties se révèle moins coûteuse et moins longue que les audiences. Les Lignes directrices sur les prix excessifs facilitent la conformité volontaire des brevetés. Ces Lignes directrices décrivent avec transparence le processus d'examen du prix afin que les brevetés soient en mesure de vendre leurs médicaments à des prix qui ne devraient pas être jugés excessifs. Les Lignes directrices sont publiées dans le Compendium des politiques, des Lignes directrices et des procédures (Compendium), lequel est affiché dans notre site Web (http://pmprb-cepmb.gc.ca) sous « Loi, Règlement et Lignes directrices ». Afin de s'assurer que ses Lignes directrices demeurent pertinentes et efficaces dans l'environnement pharmaceutique actuel et qu'elles favorisent encore les principes de justice, de transparence, d'ouverture et de prévisibilité, le Conseil a engagé en 2005 la révision de ses Lignes directrices, incluant comme le prévoit la Loi la consultation de ses principaux intervenants. En juin 2009, le CEPMB a publié la version révisée de ses Lignes directrices. Ces Lignes directrices révisées entrent en vigueur le 1er janvier 2010. Le CEPMB fera le suivi de l'application de ses nouvelles Lignes directrices et l'évaluation de l'incidence des changements apportés afin de s'assurer que les résultats attendus sont bel et bien atteints. Plans en vue de donner suite à la priorité
|
||
| Priorité opérationnelle | ||
|---|---|---|
| Créer une nouvelle base de données sur la conformité. | Type: Déjà établie | Liens avec les activités de programme 1 et 3 |
Pourquoi s'agit-il d'une priorité? La base de données dans laquelle sont versées les données sur les prix et sur les ventes dont les brevetés font rapport au CEPMB est un des principaux outils des activités de réglementation. Notre base de données qui existe depuis vingt ans a maintenant besoin d'une importante mise à niveau pour qu'elle puisse :
Plans en vue de donner suite à la priorité
|
||
| Priorité opérationnelle | ||
|---|---|---|
| Rendre le processus d'audience encore plus transparent et plus efficient. | Type: Déjà établie | Liens avec l'activité de programme 1 |
Pourquoi s'agit-il d'une priorité? Au cours des dernières années, les audiences du Conseil sont devenues plus courantes et plus complexes. Pour être en mesure de bien exercer son mandat, le Conseil doit assurer sa capacité de tenir des audiences publiques dans des délais raisonnables. En sa qualité d'organisme détenant des pouvoirs quasi judiciaires, le CEPMB doit assurer aux brevetés l'accès à une audience juste qui se tient dans des délais raisonnables. Plans en vue de donner suite à la priorité
|
||
| Priorité opérationnelle | ||
|---|---|---|
| Améliorer le profil et l'utilisation faite des résultats des recherches et des analyses faites par le CEPMB. | Type: Nouvelle | Liens avec l'activité de programme 2 |
Pourquoi s'agit-il d'une priorité? Les membres du Conseil et de la haute direction doivent pouvoir compter sur les résultats de recherches et des analyses de grande qualité pour éclairer les décisions stratégiques qu'ils sont appelés à prendre. Le CEPMB doit également s'assurer que les recherches et les analyses effectuées au titre du SNIUMP tiennent compte des besoins et des priorités des régimes F-P-T d'assurance-médicaments D'autres intervenants et clientèles de l'extérieur sont également susceptibles d'être intéressés par les résultats des analyses et des recherches du CEPMB portant sur les tendances des prix des produits pharmaceutiques. Plans en vue de donner suite à la priorité
|
||
Priorités en matière de gestion
| Priorités en matière de gestion | ||
|---|---|---|
| Améliorer la capacité interne de l'effectif et du Conseil en comblant les postes vacants. | Type: Nouvelle | Liens avec les activités de programme 1, 2 et 3 |
Pourquoi s'agit-il d'une priorité? Le niveau de référence a été rajusté pour que le Conseil soit en mesure de faire face à une augmentation de sa charge de travail découlant de la révision des Lignes directrices, des nouvelles procédures d'examen scientifique et d'examen du prix ainsi que d'une augmentation du nombre de rapports soumis par les brevetés, d'examens du prix, d'enquêtes et d'audiences. À l'instar d'autres organismes de petite taille, le CEPMB arrive difficilement à recruter des spécialistes d'expérience. Le CEPMB a réussi à doter de nouveaux postes en 2009-2010, mais il reste encore beaucoup à faire. Par ailleurs, le CEPMB connaîtra des départs au niveau de la haute direction alors que sa directrice exécutive prendra bientôt sa retraite et qu'arriveront à échéance les mandats de deux membres du Conseil nommés en vertu d'un décret du gouverneur en conseil. Plans en vue de donner suite à la priorité
|
||
| Priorité en matière de gestion | ||
|---|---|---|
| Élaborer et mettre en œuvre des plans et des politiques de gestion de l'information qui amélioreront la capacité du CEPMB de satisfaire aux besoins d'information opérationnels et de rapport. | Type: Nouvelle | Liens avec les activités de programme 1 et 3 |
Pourquoi s'agit-il d'une priorité? Tout comme pour l'intérêt public, la bonne performance du CEPMB en matière de conformité et d'application passe par une gestion efficace de l'information. Au cours des dernières années, les besoins du CEPMB en matière de gestion de l'information ont changé suite à une augmentation du nombre d'audiences et à l'imposition de plus grandes exigences en matière de rapport de gestion de la performance. Plans en vue de donner suite à la priorité
|
||
| Priorité en matière de gestion | ||
|---|---|---|
| Préparer l'évaluation en 2011-2012 du programme de conformité et d'application. | Type: Nouvelle | Liens avec l'activité de programme 3 |
Pourquoi s'agit-il d'une priorité?
Plans en vue de donner suite à la priorité
|
||
Analyse des risques
Au cours des dernières années, le Canada a connu d'importants changements d'ordres économique, social, démographique et technologique qui ont eu une incidence certaine sur l'environnement des soins de santé et des produits pharmaceutiques.
La mesure dans laquelle le CEPMB réussit à bien s'acquitter de son mandat de réglementation dépend dans une large mesure de sa capacité d'effectuer dans des délais raisonnables des examens du prix, des enquêtes et même de tenir des audiences. Depuis l'année de sa création jusqu'en 2005, le CEPMB a pu exercer son mandat sans trop recourir aux audiences publiques et ce, grâce en partie à l'efficacité de ses Lignes directrices sur les prix excessifs (Lignes directrices) et de sa politique de conformité volontaire.
En 2005-2006, le CEPMB a observé qu'il arrivait plus difficilement à bien s'acquitter de son mandat de réglementation en raison d'un nombre record d'enquêtes à faire et d'audiences sur les prix excessifs à préparer. Les intervenants se montrant de plus en plus préoccupés par les prix des médicaments et autres questions telles que les prix de lancement jugés trop élevés, le Conseil a engagé un vaste processus de révision de ses Lignes directrices incluant, comme l'exige la Loi sur les brevets, la consultation des principaux intervenants.
L'objectif de cette révision était d'assurer l'efficacité, l'équité, la transparence et la prévisibilité du processus d'examen du prix. Les consultations et les délibérations de cinq groupes de travail visaient à déterminer s'il y avait lieu de réviser les Lignes directrices et, le cas échéant, les changements à y apporter et la façon de le faire pour que les Lignes directrices soient mieux adaptées au nouvel environnement pharmaceutique. Le 9 juin 2009, le Conseil a publié ses nouvelles Lignes directrices sur les prix excessifs avec entrée en vigueur le 1er janvier 2010.
Le CEPMB pourrait être confronté à des défis au niveau de l'opérationnalisation de ses Lignes directrices. En effet, sa charge de travail devrait augmenter du fait que les examens scientifiques sont devenus plus complexes (suite à l'ajout de facteurs d'amélioration des bienfaits thérapeutiques) tout comme les examens de prix (dont les nouveaux examens au niveau du sous-marché et une nouvelle méthodologie de « dissociation » de l'IPC lorsque les augmentations de prix sont exclusivement attribuables à des changements au niveau des avantages consentis aux consommateurs). Même si elles devraient à long terme faciliter la conformité volontaire, les Lignes directrices révisées pourraient entraîner un plus grand nombre d'enquêtes et d'audiences alors que les brevetés doivent composer avec les nouvelles Lignes directrices. De plus, des pressions devraient encore s'exercer au niveau de la charge de travail, du moins à court terme, en raison des audiences qui gagnent en complexité. Ces points devront faire l'objet d'un suivi vigilant et faire possiblement l'objet de rajustements aux niveaux de la capacité et du processus, voire même des Lignes directrices.
Les ressources requises pour le suivi et l'évaluation de l'incidence des Lignes directrices révisées ainsi que pour l'analyse et les services-conseils sur les nouvelles questions touchant l'examen scientifique et l'examen du prix ont été identifiées. Le personnel du Conseil effectuera ces activités tout en traitant un plus grand volume de rapports des brevetés, effectuant les examens de prix et les enquêtes dans des délais acceptables et participant aux audiences tenues dans les meilleurs délais. Les membres du personnel du CEPMB seront également appelés à participer à un important projet de renouvellement de la technologie de l'information. Le financement requis pour ce projet a été prévu dans la mise à jour annuelle des niveaux de référence (MJANR) pour 2009-2010, mais il importera toutefois d'accorder une attention toute particulière à l'affectation de ces ressources, considérant tout particulièrement la difficulté de prévoir l'incidence qu'auront les changements apportés aux Lignes directrices sur la charge de travail.
À l'instar d'autres petits organismes, le CEPMB arrive difficilement à recruter des experts hautement qualifiés et par la suite à les garder à son service. Le CEPMB connaît également de longs délais de recrutement. À ce chapitre, l'organisation a fait des progrès importants au niveau de la dotation de nouveaux postes, mais il reste encore beaucoup à faire. Une formation devra également être offerte aux nouvelles recrues.
Par ailleurs, le CEPMB connaîtra sous peu un changement de garde au niveau de la haute direction, certains gestionnaires prendront leur retraite alors que certains membres du Conseil sont à la fin de leur mandat.
Au cours de la prochaine période de planification, le CEPMB devra assurer la planification harmonieuse des ressources humaines et des activités et veiller à ce que les activités de dotation continuent de servir les nouveaux besoins et les nouvelles orientations de l'organisation. Le cadre intégré de planification des activités et des ressources humaines assure sur une base trimestrielle l'identification, l'examen et la documentation des exigences en matière de ressources humaines ainsi que l'examen fréquent du statut des activités de dotation. Une capacité accrue des ressources humaines aura pour effet d'améliorer le soutien des différentes activités du programme.
Dans la plupart des cas, les affaires faisant l'objet d'une audience du Conseil ont porté sur des aspects scientifiques ou sur les prix des produits médicamenteux brevetés de marque. Plus récemment, certaines affaires ont aussi porté sur la compétence du Conseil, par exemple en ce qui concerne les médicaments vendus à l'extérieur du pays en vertu du programme d'accès spécial ainsi que des produits médicamenteux brevetés génériques. Même si les audiences devant le Conseil accaparent beaucoup de temps, de ressources et exigent des délibérations sérieuses, elles constituent néanmoins pour les brevetés une occasion toute choisie de saisir le Conseil de questions importantes pour leurs activités. Dans certains cas, les audiences ont mené à des requêtes de révision judiciaire devant la Cour fédérale et la Cour d'appel fédérale qui, en bout de ligne, éclairent le Conseil et les brevetés sur des questions légales importantes susceptibles d'entraîner des changements au niveau de la portée et de l'exercice du mandat de réglementation du Conseil.
Profil des dépenses
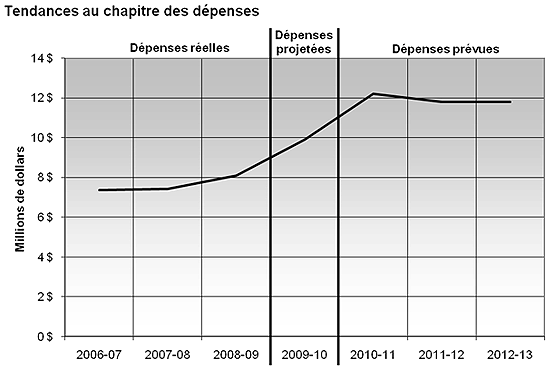
En considération de l'augmentation de sa charge de travail et aux fins d'assurer l'intégrité de son programme, le CEPMB a obtenu pour 2006-2007 une majoration de son financement de 4,9 millions de dollars au titre du Budget supplémentaire des dépenses (A). Pour l'exercice 2007-2008, il a obtenu une majoration de 5,0 millions de dollars tirés de la réserve de gestion des risques du Conseil du Trésor, augmentant ainsi son budget permanent (A) chiffré à 5 millions de dollars.
Ces montants comprenaient 4,4 millions de dollars pour couvrir les frais des audiences tenues en 2006-2007 et 3,2 millions pour les audiences tenues en 2007-2008. Ces deux sommes se sont ajoutées à une affectation à but spécial de 300 000 $. La capacité de tenir des audiences publiques dans des délais raisonnables constitue un élément de base du mandat du Conseil et de l'exercice de son autorité. Étant donné qu'il est assez difficile de prévoir le nombre d'audiences qui devront être tenues au cours d'une année donnée et du niveau de complexité de ces audiences, les sommes prévues pour les dépenses externes liées aux audiences (honoraires juridiques, témoins experts, etc.) sont placées dans l'affectation à but spécial pour qu'elles soient strictement utilisées pour ces dépenses. Tout montant non dépensé au cours d'un exercice ne peut être reporté au prochain exercice.
En prévision de l'échéance prochaine du financement temporaire accordé en 2008-2009 pour assurer l'intégrité du programme, le CEPMB a obtenu un financement additionnel permanent de 4,7 millions de dollars qui s'ajoute au budget permanent (A) de 5,8 millions de dollars. Grâce à ces crédits additionnels, le CEPMB pourra mieux faire face à une augmentation de sa charge de travail et continuer de bien s'acquitter de son mandat.
Pour l'exercice 2009-2010, le Conseil du Trésor a approuvé une majoration de 5,6 millions de dollars des niveaux de référence du crédit 35 (dépenses du Programme). Pour l'exercice 2010-2011, cette majoration est de 6,2 millions de dollars et de 5,8 millions de dollars pour l'exercice 2011-2012 et suivants (incluant le régime d'avantages sociaux des employés, mais non les frais de location versés à Travaux publics et Services gouvernementaux Canada).
Outre ces ressources supplémentaires, l'affectation à but spécial de 300 000 $ a été augmentée à 1,9 million de dollars pour 2008-2009, à 2,2 millions de dollars pour 2009-2010, à 2,8 millions de dollars pour 2010-2011 et à 2,8 millions de dollars pour 2011-2012 et suivantes. Cette affectation a pour but d'assurer au CEPMB les ressources requises pour tenir des audiences même les années où leur nombre dépasse les prévisions.
Même si les dépenses (réelles) ont augmenté année après année entre 2006-2007 et 2008-2009, il y a eu moins d'audiences que prévu, certaines affaires ayant pu être réglées au moyen d'engagements de conformité volontaire. Par ailleurs, la dotation de certains postes s'est révélée un défi. Pour l'exercice 2009-2010, le CEPMB s'attend à faire rapport de dépenses totalisant 9,6 millions de dollars par rapport à un niveau de référence final prévu de 11,8 millions de dollars.
| Poste voté ou législatif (L) | Libellé tronqué du poste voté ou législatif | 2009-2010 Budget principal des dépenses |
2010-2011 Budget principal des dépenses |
|---|---|---|---|
| 35 | Dépenses du Programme | 10 369,0 $ | 11 163,3 $ |
| (L) | Contributions aux régimes d'avantages sociaux des employés | 989,0 $ | 1 018,3 $ |
| Total pour le CEPMB | 11 358,0 $ | 12 181,6 $ | |
Section II — Analyse des activités de programme par résultat stratégique
Résultat stratégique
Le Conseil d'examen du prix des médicaments brevetés (CEPMB)
compte un seul résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin
de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également
tenue informée des tendances de l'industrie pharmaceutique.
L'indicateur de performance de ce résultat stratégique est le suivant : Au Canada les prix des médicaments brevetés se situent
dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement.
L'objectif de ce résultat stratégique est formulé comme suit : Au Canada, les prix des médicaments brevetés se situent au
niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci.
Le résultat stratégique repose sur trois activités de programme.
Activités de programme
| Ressources humaines (ETP)Ressources humaines (ETP) et Dépenses prévues (en milliers de dollars) | |||||
|---|---|---|---|---|---|
| 2010-2011 | 2011-2012 | 2012-2013 | |||
| ETP | Dépenses prévues | ETP | Dépenses prévues | ETP | Dépenses prévues |
| 44 | 7 648,8 $ | 44 | 7 654,3 $ | 44 | 7 654,3 $ |
| Résultats attendus de l'activité de programme | Indicateurs de rendement | Objectifs |
|---|---|---|
Selon les facteurs mentionnés dans la Loi sur les brevets, les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs. |
Pourcentage des médicaments brevetés qui sont jugés conformes aux Lignes directrices |
Les prix de 95 % des médicaments brevetés sont jugés conformes aux Lignes directrices. |
Sommaire de l'activité de programme
Le CEPMB exerce un contrôle sur les prix des médicaments brevetés vendus par les détenteurs de brevets au Canada pour usage humain ou pour usage vétérinaire. Au titre de cette activité de programme, le CEPMB passe en revue les prix demandés par les brevetés pour leurs médicaments brevetés en fonction des facteurs d'examen des prix prévus dans la Loi sur les brevets afin de s'assurer que ces prix ne sont pas excessifs. Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un médicament est excessif sur un marché, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à prendre les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son médicament à des prix excessifs.
Faits saillants de la planification
Le CEPMB doit s'assurer que les brevetés ne vendent au Canada leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire à des prix (prix départ-usine) considérés excessifs. Dans toute la mesure du possible, le CEPMB encourage la conformité volontaire, une avenue qui se révèle moins longue et moins onéreuse pour les différentes parties. La conformité volontaire des brevetés est facilitée par les Lignes directrices sur les prix excessifs (Lignes directrices) dont l'objet est d'aider les brevetés à vendre leurs médicaments à des prix qui ne seront pas considérés excessifs en leur expliquant à l'avance comment le personnel du Conseil effectue l'examen du prix des médicaments.
Afin de s'assurer que les Lignes directrices demeurent appropriées et efficaces et qu'elles respectent les principes d'équité, de transparence, d'ouverture et de prévisibilité, le Conseil a engagé en 2005 un processus de révision de ses Lignes directrices dans le cadre duquel il a consulté ses principaux intervenants comme le prévoit la Loi. La version révisée des Lignes directrices a été publiée en juin 2009 avec entrée en vigueur le 1er janvier 2010.
Pour la période de planification, les principales priorités du programme Conformité et d'application sont les suivantes :
- Mettre en œuvre les Lignes directrices révisées sur les prix excessifs, les politiques et les procédures et en assurer le suivi
- Concevoir une nouvelle base de données sur la conformité
- Assurer la transparence du processus d'audience ainsi qu'une plus grande efficacité
- Concevoir et mettre en œuvre des plans et des politiques de gestion de l'information qui sauront améliorer la capacité de l'organisme de satisfaire ses besoins opérationnels en matière d'information et de rapports.
Avantages pour les Canadiens
Cette activité de programme contribue au résultat recherché par le gouvernement du Canada qui est de favoriser la santé de la population canadienne en veillant à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs. Les examens de prix, les enquêtes et, lorsqu'il y a lieu, les audiences doivent être menées d'une façon transparente, efficace et dans des délais raisonnables de manière à protéger les intérêts des consommateurs et du régime canadien de soins de santé.
La direction Politiques et analyse économique veille à ce que les activités de réglementation du CEPMB demeurent pertinentes, appropriées et efficaces dans le contexte de l'environnement pharmaceutique actuel.
| Ressources humaines (ETP) et Dépenses prévues (en milliers de dollars) | |||||
|---|---|---|---|---|---|
| 2010-2011 | 2011-2012 | 2012-2013 | |||
| ETP | Dépenses prévues | ETP | Dépenses prévues | ETP | Dépenses prévues |
| 13 | 1 624,8 $ | 13 | 1 626,6 $ | 13 | 1 626,6 $ |
| Résultats attendus de l'activité de programme | Indicateurs de rendement | Objectifs |
|---|---|---|
| Les intervenants sont mieux informés des tendances des prix des produits pharmaceutiques et des facteurs à l'origine de l'augmentation des coûts en médicaments. | Nombre de demandes de publications reçues Nombre de présentations faites par le CEPMB à l'extérieur du Conseil |
Par rapport à l'exercice précédent, augmentation de 5 % du nombre de demandes de publication 10 activités par année |
Sommaire de l'activité de programme
Au titre de cette activité de programme, le CEPMB analyse les tendances en matière de prix des produits pharmaceutiques ainsi que les dépenses en recherche et développement effectuées par les détenteurs de brevets pharmaceutiques. Il effectue également des analyses critiques des tendances des prix, de l'utilisation et des coûts des médicaments sous ordonnance et collige de l'information sur les prix des médicaments non brevetés distribués sous ordonnance. Dans le rapport annuel au Parlement qu'il soumet par l'intermédiaire du ministre de la Santé, le CEPMB fait rapport de ces études analytiques, des résultats de ses examens des prix des médicaments et de ses activités d'application de la loi relativement aux prix excessifs pour les médicaments brevetés.
Faits saillants de la planification
Pour la période de planification, la principale priorité du programme Rapports sur les tendances relatives aux produits pharmaceutiques est la suivante :
- Améliorer le profil des recherches et des analyses effectuées par le CEPMB ainsi que l'utilisation faite des rapports.
Avantages pour les Canadiens
Cette activité de programme aide comme suit le gouvernement du Canada à assurer la bonne santé de sa population :
- éclairer le processus de prise de décisions concernant les médicaments en faisant rapport des tendances des prix des produits médicamenteux ainsi que des dépenses de R-D des brevetés au Canada, et
- préparer à l'intention du régime canadien de soins de santé des analyses critiques des prix des produits médicamenteux, de l'utilisation faite de ces produits et des tendances au niveau de leurs coûts et, ainsi, lui fournir des renseignements complets et fiables sur la façon dont sont utilisés les médicaments d'ordonnance et sur la source des pressions exercées au niveau des coûts.
| Ressources humaines (ETP) et Dépenses prévues (en milliers de dollars) | |||||
|---|---|---|---|---|---|
| 2010-2011 | 2011-2012 | 2012-2013 | |||
| ETP | Dépenses prévues | ETP | Dépenses prévues | ETP | Dépenses prévues |
| 19 | 2 908,0 $ | 19 | 2 535,3 $ | 19 | 2 535,3 $ |
Sommaire de l'activité de programme
Les services internes sont des groupes d'activités et de ressources connexes qui sont gérés de façon à répondre aux besoins des programmes et des autres obligations générales d'une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services des communications, services juridiques, services de gestion des ressources humaines, services de gestion des finances, services de gestion de l'information, services des technologies de l'information, services de gestion des biens, services de gestion du matériel, services de gestion des acquisitions et services de gestion des voyages et autres services administratifs. Les services internes comprennent uniquement les activités et les ressources destinées à l'ensemble d'une organisation et non celles fournies à un programme particulier.
Faits saillants de la planification
Cette activité de programme sera encore largement consacrée aux activités courantes dont l'objet est de soutenir la prestation du programme.
Pour la période de planification, les principales priorités du programme Services internes sont les suivantes :
- Concevoir une nouvelle base de données sur la conformité
- Consolider la capacité interne du personnel du Conseil et du Conseil en dotant les postes vacants
- Élaborer et mettre en œuvre des plans et des politiques en matière de gestion de l'information qui sauront améliorer la capacité de satisfaire les besoins opérationnels et les besoins d'information
- Préparer l'évaluation du programme Conformité et application qui sera faite au cours de l'exercice 2011-2012
Section III — Renseignements supplémentaires
Tableaux supplémentaires
Tous les tableaux de renseignements supplémentaires en version électronique du Rapport sur les plans et les priorités 2010‑2011 sont disponibles sur le site Web du Secrétariat du Conseil du Trésor du Canada, à l'adressehttp://www.tbs-sct.gc.ca/rpp/2010-2011/info/info-fra.asp.
Sources des revenus non disponibles
Achats écologiques
Évaluations à venir (trois prochains exercices)
Autres sujets d'intérêt
Rapport annuel 2008 du CEPMB(http://www.pmprb-cepmb.gc.ca/francais/View.asp?x=91&mp=68)
La Nouvelle (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=287&mp=68)
Guide du breveté (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=146)
Compendium des Lignes directrices, politiques et procédures (mars 2008) (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1034)
Compendium des politiques, des Lignes directrices et des procédures, juin 2009 (en vigueur le 1er janvier 2010) http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1206&mp=808
Loi sur les brevets (http://laws.justice.gc.ca/fr/showtdm/cs/P-4)
Règlement sur les médicaments brevetés (http://laws.justice.gc.ca/fr/showtdm/cr/DORS-94-688)
1 De plus, conformément à la Loi sur les brevetés, cinq membres siègent à temps partiel au Conseil. Ces membres sont nommés en vertu d'un décret du gouverneur en conseil.
2 Vous trouverez à la Section II la description/sommaire des activités de programme.
3 Le CEPMB n'a qu'un résultat stratégique. Ainsi donc, toutes les priorités sont associées à ce résultat. Vous trouverez dans la présente colonne les liens menant à l'activité de programme.