ARCHIVÃ - Conseil dâexamen du prix des mÃĐdicaments brevetÃĐs - Rapport
 Cette page a ÃĐtÃĐ archivÃĐe.
Cette page a ÃĐtÃĐ archivÃĐe.
Information archivÃĐe dans le Web
Information archivÃĐe dans le Web à  des fins de consultation, de recherche ou de tenue de documents. Cette derniÃĻre nâa aucunement ÃĐtÃĐ modifiÃĐe ni mise à  jour depuis sa date de mise en archive. Les pages archivÃĐes dans le Web ne sont pas assujetties aux normes qui sâappliquent aux sites Web du gouvernement du Canada. ConformÃĐment à  la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à  la page ÂŦ Contactez-nous Âŧ.
2010-2011
Rapport ministÃĐriel sur le rendement
Conseil dâexamen du prix des mÃĐdicaments brevetÃĐ
La version originale a ÃĐtÃĐ signÃĐe par
L'honorable Leona Aglukkaq
Ministre de la SantÃĐ
Table des matičres
- Raison d'ętre
- Responsabilités
- Résultat stratégique et Architecture des activités de programmes (AAP)
- Priorités organisationnelles
- Analyse des risques
- Sommaire du rendement
- Profil des dépenses
- Budget des dépenses par crédit voté
Section II : Analyse des activités de programme par résultat stratégique
- Résultat stratégique
- Activité de programme 1
- Sommaire du rendement et analyse de l’activité de programme 1
- Leįons apprises
- Activité de programme 2
- Sommaire du rendement et analyse de l’activité de programme 2
- Leįons apprises
- Activité de programme 3
- Sommaire du rendement et analyse de l’activité de programme 3
Section III : Renseignements supplémentaires
Section IV: Autres sujets d'intéręt
Message de la présidente
C’est avec plaisir que je soumets le Rapport ministériel sur le rendement 2010‑2011 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB, un organisme indépendant qui détient des pouvoirs quasi judiciaires, a été créé par le Parlement en 1987 conformément ā la Loi sur les brevets. Le Conseil est investi d’un double mandat, ā savoir de réglementation et de rapport. En vertu de son mandat de réglementation, le CEPMB veille ā ce que les prix des médicaments brevetés distribués au Canada ne soient pas excessifs. Au titre de son mandat de rapport, il fait rapport des tendances relatives aux prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement. De faįon générale, le CEPMB contribue ā l’amélioration de la condition de santé de la population canadienne, et ce, en protégeant les intéręts des consommateurs et du régime canadien de soins de santé. Ā cette fin, il s’assure que les produits médicamenteux brevetés ne sont pas vendus ā des prix excessifs et tente d’éclairer le processus décisionnel dans le cadre de l’élaboration de politiques en matičre de médicaments.
En 2010, 1 196 produits pharmaceutiques brevetés relevaient de la compétence du Conseil, dont 68 nouveaux médicaments brevetés ayant fait l’objet d’un rapport au cours de cette męme année.
Le Conseil a confirmé que la promotion de son engagement auprčs des intervenants et le renforcement de la liaison auprčs des brevetés constituaient des priorités ā la suite de la mise en œuvre de ses Lignes directrices révisées, en janvier 2010. La surveillance des répercussions ā court et ā long terme des modifications a fourni davantage de possibilités de dialogue avec les brevetés, en plus de permettre au Conseil d’apporter en temps opportun des modifications sur le champ. La publication récente du Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices fait partie de l’engagement de longue date du Conseil envers un régime de réglementation qui est pertinent, réceptif et approprié.
La capacité du CEPMB de bien s’acquitter de son mandat de réglementation ne repose pas seulement sur la pertinence et l’efficacité des Lignes directrices, mais aussi sur sa capacité de tenir des audiences lorsque cela s’impose. Męme si les audiences publiques comportent un important facteur temps et qu’elles exigent d’importantes ressources et de sérieuses délibérations, elles offrent aux brevetés la possibilité de prendre la parole. Bien que ces audiences puissent mener ā des révisions judiciaires devant la Cour fédérale, elles procurent ā toutes les parties des clarifications essentielles sur l’intention de la loi. En 2011, l’une de ces clarifications importantes a été présentée dans l’affaire Celgene Corporation, par la Cour supręme du Canada, qui a confirmé des éléments clés de la compétence du Conseil ainsi que son rôle en matičre de protection des consommateurs.
Le Conseil s’est également concentré sur un examen complet de ses Rčgles de pratique et de procédure aux fins des audiences. La codification de ses pratiques et procédures, ainsi que la prise en compte des pratiques courantes des autres tribunaux administratifs fédéraux et des Rčgles de la Cour fédérale (RCF) qui s’appliquent dans le contexte du Conseil, devraient permettre d’améliorer la transparence et la rapidité du processus.
Dans le cadre du Systčme national d’information sur l’utilisation des médicaments prescrits (SNIUMP), le CEPMB a poursuivi son partenariat avec l’Institut canadien d’information sur la santé (ICIS), Santé Canada, les provinces et les territoires. Dans le cadre de l’initiative du SNIUMP, on fournit des analyses critiques des tendances observées au niveau des prix, de l’utilisation et des coûts, en vue d’éclairer l’élaboration des politiques, de promouvoir son efficacité et de la rentabiliser. Avec la publication des résultats des études réalisées au titre du SNIUMP, la collectivité des soins de santé dans son ensemble peut connaître les avantages que présentent ces travaux.
Le CEPMB a également harmonisé la planification de ses ressources humaines avec celle de ses activités, afin de demeurer réceptif aux priorités opérationnelles et d’appuyer les besoins organisationnels en évolution.
En 2010-2011, le CEPMB a mis la derničre main ā un cadre de stratégie de mesure du rendement (CSMR), qu’il a élargi afin d’inclure sa deuxičme activité de programme, ā savoir l’analyse des tendances relatives aux produits pharmaceutiques. Alors que le CEPMB se prépare ā effectuer la prochaine évaluation de ses programmes, il demeure déterminé ā exercer son mandat de réglementation et de rapport d’une maničre prévisible, juste et transparente, ainsi qu’ā maintenir son engagement auprčs de ses intervenants clés.
La version originale a été signée par
Mary Catherine Lindberg
Présidente
Section I : Survol du Conseil
Raison d’ętre
Le mandat du Conseil d’examen du prix des médicaments brevetés (CEPMB) comporte les deux volets suivants :
Réglementation — Veiller ā ce que les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne soient pas excessifs.
Rapport — Faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des brevetés dans la R-D au Canada.
Responsabilités
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires, créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Ŧ Loi ŧ) dans sa version modifiée (projet de loi C-22). La Loi a été modifiée ā nouveau en 1993 (projet de loi C‑91). Les révisions visaient ā établir un juste équilibre entre la prolongation de la période de protection associée au brevet et la nécessité de protéger les intéręts des consommateurs en s’assurant que les médicaments brevetés ne soient pas vendus ā des prix excessifs.
Rôle de réglementation
Le CEPMB vérifie les prix départ-usine, ā savoir les prix auxquels les brevetés vendent, au Canada, ā leurs différents clients (grossistes, hôpitaux, pharmacies et autres) leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre et veille ā ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque produit médicamenteux breveté. C’est généralement ā ce niveau que Santé Canada attribue le numéro d’identification du médicament (DIN) en vertu du processus d’attribution de l’Avis de conformité. Le mandat du Conseil couvre également les produits médicamenteux distribués au titre du Programme d’accčs spécial, les produits médicamenteux distribués en vertu du programme d’essais cliniques et les drogues nouvelles de recherche.
La Cour d’appel fédérale a été appelée ā déterminer les conditions oų un brevet est légalement lié ā un médicament. Ā cet égard, la Cour a établi qu’il doit exister entre le brevet et le médicament Ŧ un lien męme ténu ŧ, ce qui sous-tend une application assez vaste de la compétence du Conseil. La compétence du Conseil s’applique aux produits médicamenteux dont le brevet porte sur son ingrédient actif, mais également aux produits médicamenteux auxquels un brevet est lié, que ce brevet vise un procédé de fabrication, un mode d’administration, une forme posologique, une indication ou une utilisation, une préparation ou autre. Les produits médicamenteux brevetés ne sont pas nécessairement non plus des produits de marque. En effet, certains fabricants de produits génériques sont assujettis ā la compétence du Conseil du fait qu’ils vendent en vertu d’une licence d’exploitation le męme produit que le produit de marque ou, encore, qu’ils sont titulaires d’un brevet visant le procédé de conditionnement ou de traitement de produits.
Le CEPMB n’est pas habilité ā réglementer les prix des produits médicamenteux non brevetés. Il n’a aucun droit de regard sur les prix de vente au gros et au détail des produits médicamenteux brevetés et non brevetés ni sur les honoraires des pharmaciens. Des questions telles que le remboursement des médicaments par les régimes publics ou privés d’assurance-médicaments, les canaux de distribution et les habitudes d’ordonnance ne relčvent pas non plus de sa compétence.
En vertu de la Loi, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté. Aprčs leur premičre vente, les brevetés doivent, conformément au Rčglement sur les médicaments brevetés, faire rapport du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, tous les six mois (de janvier ā juin et de juillet ā décembre), ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs produits médicamenteux aux fins de l’examen et de la réglementation de leurs prix, et ce, tant qu’un brevet est lié au produit médicamenteux.
Męme s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter ā la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits médicamenteux brevetés ne soient pas jugés excessifs. Lorsqu’un produit médicamenteux breveté est vendu au Canada avant l’attribution de son brevet, l’examen de son prix est rétroactif ā la date de sa premičre vente si celle-ci est ultérieure ā la date ā laquelle la demande de brevet a été rendue publique.
Lorsque, ā l’issue d’une audience publique, il apparaît que le prix d’un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance obligeant le breveté ā réduire le prix de son médicament et ā appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives qu’il a tirées de la vente de son médicament ā un prix excessif.Rapport
Chaque année, par l’intermédiaire du ministre de la Santé, le CEPMB fait rapport au Parlement de ses activités, des tendances des prix des produits pharmaceutiques brevetés et des dépenses des brevetés dans la recherche-développement. En plus de ces responsabilités d’établissement de rapports, en vertu de l’article 90 de la Loi, le ministre de la Santé a le pouvoir d’ordonner au CEPMB de faire enquęte sur toute autre question. Selon cette disposition, le ministre a ordonné au CEPMB de réaliser deux initiatives : le Systčme national d’information sur l’utilisation des médicaments prescrits (SNIUMP) et le suivi et le rapport des tendances des prix des médicaments non brevetés distribués sous ordonnance.
Systčme national d’information sur l’utilisation des médicaments prescrits (SNIUMP)
Depuis 2001, en application d’une entente intervenue entre les ministres fédéral, provinciaux et territoriaux (F-P-T) de la Santé, le CEPMB effectue des recherches au titre de l’initiative du SNIUMP. L’initiative du SNIUMP a pour fonction de produire des analyses critiques des prix des médicaments distribués sous ordonnance, de l’utilisation faite de ces médicaments et des tendances observées au niveau de leurs coûts et de présenter ses conclusions aux décideurs du régime canadien de soins de santé pour améliorer leur compréhension de la faįon dont les médicaments d’ordonnance sont utilisés au Canada et des facteurs ā l’origine de l’augmentation de leurs coûts.
Prix des médicaments non brevetés distribués sous ordonnance
En 2005, intervenant aux noms des ministres F-P-T de la Santé, le ministre fédéral de la Santé a chargé le CEPMB d’exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Les ministres de la Santé souhaitaient ainsi constituer une source centralisée de données fiables sur les prix de ces médicaments. Depuis avril 2008, les études sur les prix des médicaments non brevetés distribués sous ordonnance sont effectuées au titre du SNIUMP.
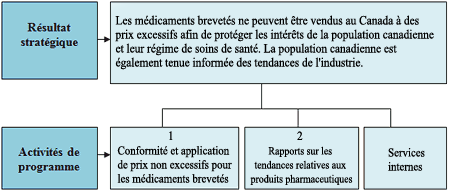
Résultat stratégique et Architecture des activités de programmes (AAP)
Le CEPMB compte un résultat stratégique (RS) et deux activités de programme (AP), qui sont illustrés dans le graphique présenté ci-aprčs.
Priorités organisationnelles
Légende du statut prioritaire
Dépassée : Plus de la totalité du niveau de rendement attendu par rapport au résultat attendu ou ā la priorité précisée dans le RPP a été atteinte au cours de l’exercice.
Entičrement atteinte : La totalité du niveau de rendement attendu par rapport au résultat attendu ou ā la priorité précisée dans le RPP a été atteinte au cours de l’exercice.
Atteinte en grande partie : De 80 ā 99 p. 100 du niveau de rendement attendu par rapport au résultat attendu ou ā la priorité précisée dans le RPP a été atteint au cours de l’exercice.
Passablement atteinte : De 60 ā 79 p. 100 du niveau de rendement attendu par rapport au résultat attendu ou ā la priorité précisée dans le RPP a été atteint au cours de l’exercice.
Non atteinte : Moins de 60 p. 100 du niveau de rendement attendu par rapport au résultat attendu ou ā la priorité précisée dans le RPP a été atteint au cours de l’exercice.
| Priorité : Mettre en œuvre les Lignes directrices révisées sur les prix excessifs, les politiques et les procédures et en assurer le suivi. | Type1: Nouvelle | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée ā l’AP 1. |
|---|---|---|
|
Progrčs accomplis : Priorité entičrement atteinte Les Lignes directrices révisées représentent la directive qu’a donnée le Conseil aux brevetés et ā son personnel, quant ā la faįon de respecter la Loi sur les brevets et le Rčglement sur les médicaments brevetés. Les Lignes directrices révisées sont entrées en vigueur le 1er janvier 2010. On les a d’ailleurs utilisées pour effectuer les examens de prix pour tous les nouveaux produits médicamenteux brevetés vendus ā partir du 1er janvier 2010 et, le cas échéant, les nouveaux produits médicamenteux vendus ā une date antérieure ā laquelle le prix faisait toujours l’objet d’un examen en date du 1er janvier 2010 et les demandes de brevets pour la période visée par le rapport, soit du 1er janvier au 30 juin 2010. Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a élaboré le Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices (le Plan), afin d’évaluer, de faįon continue, l’application et les répercussions des principales modifications apportées aux Lignes directrices. Le Plan comprend, entre autres, des renseignements sur les indicateurs (qualitatifs et quantitatifs) conįus pour mesurer les répercussions des modifications apportées aux Lignes directrices. Les centres de responsabilité ont déjā entrepris de concevoir les outils et de recueillir les renseignements dont ils auront besoin pour évaluer et pour établir des rapports sur l’application et les répercussions des modifications apportées aux Lignes directrices. Les premiers résultats de ce contrôle ont donné lieu ā plusieurs précisions sur certains aspects des Lignes directrices. On a communiqué ces précisions aux brevetés et ā d’autres intervenants, au moyen de La Nouvelle2 du CEPMB, et de séances de sensibilisation éducatives et de liaison3. Tout particuličrement, on a établi que l’examen des prix Ŧ sur un marché ŧ et la méthodologie de la majoration pour les produits médicamenteux brevetés existants méritaient un examen plus approfondi4. On a donc mis sur pied, en collaboration avec des représentants de l’industrie, le groupe de travail sur la méthodologie de la majoration, afin d’aider le personnel du Conseil ā formuler des recommandations de solutions utiles pour appliquer la méthodologie de la majoration. Le groupe de travail a présenté son rapport final au Conseil, dans le cadre de sa réunion trimestrielle, qui se tenait le 4 mars 2011. Le Conseil a décidé de mettre en œuvre les recommandations du groupe de travail ā titre de projet pilote jusqu’au 31 décembre 2011, date ā laquelle on évaluera leur efficacité5. Ā mesure que le CEPMB et les brevetés se familiarisent avec les Lignes directrices révisées, il se peut qu’on apporte des modifications ou des précisions supplémentaires. Ces changements seront publiés dans l’édition trimestrielle de La Nouvelle, au besoin, et ajoutés aux Lignes directrices. Le Compendium des politiques, des Lignes directrices et des procédures sera mis ā jour annuellement, en juin. |
||
| Priorité : Créer une nouvelle base de données sur la conformité. | Type1: Déjā établie | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée aux AP 1, 2 et 3. |
|---|---|---|
|
Progrčs accomplis : Atteinte en grande partie La base de données sur la conformité est un outil essentiel ā la poursuite des activités de réglementation et, par le fait męme, au programme de conformité et d’application. Le fait de renforcer la base de données contribuera ā réduire les délais du processus d’examen du prix. En outre, le fait d’utiliser de nouvelles technologies facilitera l’interopérabilité et l’échange de données, en plus de simplifier l’établissement de rapports pour les brevetés et d’accroître l’intégrité et la sécurité des données utilisées pour le programme de conformité et d’application et celui des tendances relatives aux produits pharmaceutiques. Cette plus grande sécurité des données permettra au CEPMB d’aller de l’avant avec les rapports sécurisés en ligne. En 2010-2011, le CEPMB a établi les exigences opérationnelles et a conįu l’architecture de la base de données, puis, il a bâti un prototype et créé la nouvelle base de données, au moyen d’un processus de conception itératif, qui comprend des consultations continues sur la conception avec des experts en la matičre. Le processus intensif de nettoyage et de conversion de données a été perturbé par la complexité de cette base de données, qui automatise les calculs des examens des prix qui ont changé au fil des ans et, plus récemment, en raison de l’adoption des Lignes directrices révisées. Ces défis ont obligé le CEPMB ā utiliser l’ancienne base de données et la nouvelle en parallčle un peu plus longtemps que ce qui était prévu au départ; on a également dû prolonger le calendrier du projet d’environ six mois La nouvelle base de données est actuellement mise ā l’essai rigoureusement et les employés ont suivi une formation ā ce sujet. Les rapports soumis en juillet 2011 seront traitées dans l’ancien et le nouveau systčme; toute anomalie qui en découlera sera résolue, dans le but d’effectuer la mise en œuvre complčte en septembre 2011. Les économies et les capacités de rendre compte continueront d’évoluer avec le cycle de vie de la base de données. |
||
| Priorité : Rendre le processus d’audience encore plus transparent et plus efficient. | Type1: Déjā établie | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée ā l’AP 1. |
|---|---|---|
|
Progrčs accomplis : Atteinte en grande partie Le fait de veiller ā la transparence et ā une plus grande efficience du processus d’audience accélérera la prise de décisions, notamment en ce qui concerne les prix excessifs, et, ainsi, permettra de veiller ā ce que les Canadiens et leur systčme de santé soient protégés des prix excessifs de médicaments brevetés. Afin de rendre le processus d’audience plus transparent, le CEPMB affiche sur son site Web toutes les décisions rendues par le Conseil dans les 3 jours suivant leur communication. En outre, la publication trimestrielle La Nouvelle comprend un rapport de situation sur les audiences devant le Conseil. On peut trouver le plus récent rapport de situation dans le dernier volume de La Nouvelle, accessible sur la page d’accueil du site Web du CEPMB, au : www.pmprb-cepmb.gc.ca. Les activités quasi judiciaires sont quant ā elles présentées dans le Rapport annuel. Les Rčgles de pratique et de procédure (Rčgles) constituent un ensemble publié de procédures établies ā l’intention de toutes les parties participant ā des audiences devant le Conseil. Les Rčgles énoncent les procédures du Conseil sur la base du mandat qu’a ce dernier, en vertu de la Loi sur les brevets, de résoudre les questions soumises ā son attention de la maničre la plus informelle et expéditive possible, dans la mesure oų les circonstances le permettent et dans le respect de l’équité. En décembre 2010, le Conseil a décidé de mener de plus amples consultations afin de permettre ā des avocats choisis en raison de leur expérience devant les tribunaux administratifs, comme le CEPMB, de commenter ses Rčgles. En mars 2011, le Conseil a approuvé la révision définitive proposée des Rčgles, qui codifient les pratiques et procédures actuelles du Conseil et tiennent compte des pratiques en vigueur dans d’autres tribunaux administratifs fédéraux ainsi que des Rčgles de la Cour fédérale, et l’a présentée dans le cadre de son processus d’Avis et commentaires, aux fins de consultations élargies. La publication de la révision définitive des Rčgles dans la Gazette du Canada, partie I, aux fins de consultation officielle, a donc été reportée au dernier trimestre de l’exercice 2011-2012. |
||
| Priorité : Améliorer le profil et l’utilisation faite des résultats des recherches et des analyses faites par le CEPMB. | Type1:Nouvelle | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée ā l’AP 2. |
|---|---|---|
|
Progrčs accomplis : Entičrement atteinte Le personnel du CEPMB mčne une analyse approfondie des tendances dans l’industrie pharmaceutique, ā l’échelle internationale et nationale. Les tendances en matičre de prix, d’utilisation et de recherche et développement (R-D) font partie des exposés réguliers présentés au Conseil et ā la haute direction. Le Rapport annuel du CEPMB présente des analyses des prix de produits médicamenteux brevetés et des renseignements sur les tendances en matičre de prix pour tous les médicaments, en plus de rendre compte des dépenses de R-D pharmaceutiques des brevetés du milieu pharmaceutique. Outre son Rapport annuel, le CEPMB rend compte de ses activités dans sa publication trimestrielle, La Nouvelle, et dans différentes études. En 2010-2011, le CEPMB a pris part ā une initiative dirigée par Industrie Canada, afin d’examiner la nature des dépenses en R-D pharmaceutique et des investissements au Canada6. Le CEPMB faisait donc partie d’un groupe de travail technique, mis sur pied pour aider ā concevoir le questionnaire du sondage et pour offrir des conseils sur la portée des données ā recueillir, de męme que sur les enjeux possibles en matičre de mesure et de collecte, afin de veiller ā ce que les résultats ne soient pas une réplique de mesures gouvernementales déjā en place, mais informatifs et utiles pour les décideurs. Ā titre de membre du Comité directeur, le CEPMB a fourni une orientation, étant donné son mandat de faire rapport au Parlement des dépenses des brevetés dans la R-D, en vertu de la Loi sur les brevets. On peut consulter les résultats du sondage, Résumé des conclusions du sondage du secteur pharmaceutique sur les dépenses en R&D et autres investissements de la part des membres de Rx&D en 2010, issus de cette initiative, sur le site Web des Instituts de recherche en santé du Canada. Le CEPMB a également travaillé ā mettre ā jour son étude des niveaux internationaux de R-D, ainsi que son évaluation des tendances des prix internationaux des médicaments brevetés. Ces deux études doivent ętre publiées en 2011. Le 15 décembre 2010, le CEPMB a publié quatre nouveaux rapports de synthčse :
Les deux rapports sur les médicaments génériques en particulier ont suscité un vif intéręt auprčs d’un large public. Le CEPMB a donné un préavis de ces publications au Conseil canadien de la santé, ā l’Association canadienne du médicament générique et ā d’autres intervenants. Le Conseil canadien de la santé a fait référence au travail accompli par le CEPMB dans son rapport et a demandé de présenter une mise ā jour sur ce dernier. Les évaluations mises ā jour donneront un aperįu ponctuel et une meilleure référence pour évaluer les changements en matičre de politiques publiques, actuelles et futures, sur le prix des médicaments génériques au Canada. Les renseignements sur les publications du SNIUMP et les rapports de situation sont accessibles ā une vaste communauté d’intervenants, au moyen de la publication La Nouvelle et du Rapport annuel du CEPMB. On fournit également des renseignements dans le cadre de certaines réunions (p. ex. la Conférence annuelle 2010 de l’ACRSPS). Le Comité directeur du SNIUMP a fait part de son souhait d’élaborer une stratégie de communication plus globale pour le SNIUMP. Une stratégie de communication, destinée ā améliorer le profil et l’utilisation de la recherche menée par le SNIUMP au sein de la plus vaste communauté d’intervenants, figure ā l’ordre du jour de la rencontre en personne des membres du Comité directeur. En outre, en mars 2011, dans son effort pour créer et maintenir un engagement continu avec les intervenants de l’extérieur de l’industrie, le Conseil a approuvé une politique d’engagement des intervenants de l’extérieur de l’industrie8. Cette politique et le plan d’engagement qui en découle visent ā sensibiliser les intervenants de l’extérieur de l’industrie sur le rôle de rapport du CEPMB. Pendant l’exercice 2011-2012, le CEPMB reverra l’approche et le style de ses bulletins électroniques et commencera ā publier ses mémoires d’analyse (des résumés de haut niveau, d’une ā deux pages, contenant les récentes analyses de recherche qu’a entreprises le CEPMB). Ces mémoires résumeront les constatations intéressantes les plus importantes et seront diffusés aux différents intervenants par voie électronique. |
||
| Priorité : Consolider la capacité interne du personnel du Conseil et du Conseil en dotant les postes vacants. | Type1: Nouvelle | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée ā aux AP 1 et 2. |
|---|---|---|
|
Progrčs accomplis : Priorité entičrement atteinte Ā l’instar d’autres organismes de petite taille, le CEPMB arrive difficilement ā recruter et ā conserver des spécialistes d’expérience. Il est donc primordial de planifier harmonieusement les ressources humaines et les activités au moyen de vérifications réguličres des plans de ressourcement, afin de garantir notre capacité ā mener l’ensemble des activités de programme. Tout au long de l’exercice 2010-2011, les plans des ressources humaines ont réguličrement fait l’objet de discussions lors des réunions du Comité de gestion; on a également effectué des examens officiels chaque trimestre. On a amélioré la capacité en matičre de dotation, afin que les activités de dotation opérationnelle puissent soutenir les nouveaux besoins de l’organisation. L’augmentation du financement pour l’exercice 2008-2009 a permis au CEPMB de doter tous les postes, hormis ceux qui doivent rester vacants, afin de respecter les mesures de limitation des coûts instaurées dans l’ensemble du gouvernement. En septembre 2010, une nouvelle directrice exécutive s’est jointe au CEPMB et, en mars 2011, une nouvelle présidente et un nouveau vice-président ont été nommés par le gouverneur en conseil. |
||
| Priorité : Élaborer et mettre en œuvre des plans et des politiques en matičre de gestion de l’information qui sauront améliorer la capacité de satisfaire les besoins opérationnels et les besoins d’information. | Type1: Nouvelle | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée aux AP 1 et 3. |
|---|---|---|
|
Progrčs accomplis : Priorité entičrement atteinte En 2010-2011, le CEPMB a doté un poste de niveau supérieur en gestion de l’information, afin de fournir une capacité en matičre de politique de GI, de concevoir des plans ā long terme et d’amorcer l’introduction d’améliorations d’ordre technologique. Le CEPMB a également entrepris d’examiner les politiques et lignes directrices établies par le gouvernement du Canada afin de s’assurer qu’il les respectait, il a formé son personnel sur la gestion de l’information et il a choisi deux nouveaux systčmes pour l’aider ā gérer les dossiers ministériels. On travaille ā mettre en œuvre une solution de gestion des documents électroniques, dont le projet pilote devrait ętre présenté ā la Direction des services généraux au cours du prochain exercice. En outre, on a acheté un logiciel pour faciliter la gestion de documents liés ā la fonction quasi judiciaire du CEPMB; on prévoit que le déploiement de ce logiciel aura lieu ā l’été 2011. Dčs la mise en œuvre de cette solution de gestion des documents électroniques, on entreprendra l’examen des politiques et des procédures de l’Accčs ā l’information et protection des renseignements personnels (AIPRP). |
||
| Priorité : Préparer l’évaluation du programme Conformité et application qui sera faite au cours de l’exercice 2011-2012. | Type1: Nouvelle | Résultat stratégique ou activité de programme : Le CEPMB n’a qu’un résultat stratégique (RS). Ainsi donc, toutes les priorités sont associées ā ce RS. Cette priorité est liée ā l’AP 3. |
|---|---|---|
|
Progrčs accomplis : Priorité entičrement atteinte Dans le cadre de son engagement ā ętre transparent et ā assurer la valeur des dépenses des fonds publics, le CEPMB s’engage ā entreprendre un examen en vue d’évaluer la mesure dans la laquelle les ressources supplémentaires fournies durant l’exercice 2008‑2009 l’ont aidé ā atteindre son objectif stratégique de protéger la population canadienne et le régime canadien de soins de santé contre la pratique de prix excessifs pour les produits médicamenteux brevetés vendus au Canada et de l’informer sur les tendances relatives aux produits pharmaceutiques. En 2010-2011, le CEPMB a mis au point un cadre de stratégie de mesure du rendement (CSMR), qui a été élargi afin d’inclure sa deuxičme activité de programme, l’analyse des tendances relatives aux produits pharmaceutiques. Cette stratégie comprend un cadre d’évaluation, notamment des indicateurs de rendement, des sources de données et des méthodes de collecte de données. Les directions ont commencé ā recueillir des données afin de satisfaire aux exigences en matičre d’établissement de rapports et de contribuer au suivi du rendement ā l’interne. Les données utiles sur le rendement des activités de programme aideront les gestionnaires ā orienter leurs ressources de faįon optimale. Une évaluation du programme en entier devrait avoir lieu au cours des deux derniers trimestres de l’exercice 2011-2012. |
||
Analyse des risques
En 2005-2006, le CEPMB a entrepris un examen approfondi de ses Lignes directrices, qui comprenait des consultations auprčs de ses principaux intervenants comme le prévoit la Loi sur les brevets (la Loi). Cet examen a pris fin avec la publication, par le Conseil, des nouvelles Lignes directrices sur les prix excessifs, en juin 2009. Ces nouvelles Lignes directrices sont entrées en vigueur le 1er janvier 2010.
Comme prévu, le CEPMBCEPMB a été confronté ā des défis au niveau de l’opérationnalisation de ses Lignes directrices révisées. Durant la phase de mise en œuvre, on a ciblé certains éléments des nouvelles Lignes directrices, qui demandaient d’ętre éclaircis ou de faire l’objet de discussions plus approfondies. En guise de réponse, le Conseil a tôt fait de clarifier l’interprétation et l’application des Lignes directrices et d’adopter des approches destinées ā faciliter la mise en œuvre efficiente des nouveaux éléments des Lignes directrices. On a utilisé des communiqués, des articles publiés dans La Nouvelle et des ateliers en personne (Ŧ séances de liaison ŧ) tout au long de cette période, afin d’améliorer la compréhension et le respect des Lignes directrices. En outre, on a mis sur pied un groupe de travail9, auquel participaient des membres provenant de l’extérieur, afin d’élaborer des recommandations quant ā la Ŧ méthodologie de la majoration10 ŧ.
En mars 2011, le Conseil a également approuvé le Plan de surveillance et d’évaluation des principales modifications aux Lignes directrices, qui a pour but de servir d’outil de gestion interne pour aider le Conseil ā évaluer les répercussions et l’application des changements importants apportés aux Lignes directrices. Il se pourrait que ces répercussions ne soient pas visibles dans l’immédiat, étant donné le décalage entre la mise en œuvre et l’établissement de rapports par les brevetés, et le fait qu’il se peut que plusieurs périodes de déclaration s’écoulent avant que l’on ne voie se dessiner une tendance. Par conséquent, on continuera de surveiller de prčs et d’évaluer les répercussions des nouvelles Lignes directrices, ce qui permettra d’apporter des rajustements et des modifications au besoin, et le personnel du Conseil présentera un rapport annuel au Conseil dans le cadre de sa réunion de l’automne (ā compter d’octobre 2011).
On a réalisé des économies dans le processus d’examen des prix, afin de répondre aux demandes de la charge de travail. Le nombre d’enquętes commencées durant l’exercice 2010-2011 a diminué par rapport ā la période de rapport antérieure. Le Conseil a remarqué que les changements dans les modčles de distribution et de fixation des prix ont posé des défis au cadre de réglementation actuel et aux Lignes directrices; on peut s’attendre ā ce qu’ils continuent de le faire. Durant la derničre période, le Conseil est devenu préoccupé par le fait que les prix élevés de certains nouveaux produits médicamenteux puissent amener ā se demander si les approches actuelles en matičre d’examen des prix de lancement sont vraiment efficaces. Le Conseil continuera donc d’évaluer son programme, ainsi que les résultats qu’il obtient.
Comme on l’avait prévu, en 2010-2011, les affaires faisant l’objet d’une audience du Conseil ont porté sur des aspects scientifiques ou sur les prix des produits médicamenteux brevetés de marque. Certaines ont également porté sur l’étendue de la compétence du Conseil en ce qui a trait ā la définition de Ŧ breveté ŧ et sur le fait de savoir si certaines activités sont considérées comme des ventes au Canada. Męme si les audiences devant le Conseil accaparent beaucoup de temps, de ressources et exigent des délibérations sérieuses, elles constituent néanmoins pour les brevetés une occasion toute choisie de saisir le Conseil de questions importantes pour leurs activités. En 2010, le Conseil a délivré un Avis d’audience au sujet d’un défaut de soumettre des rapports, des décisions et des ordonnances menant ā terme trois audiences et une ordonnance supplémentaire relativement ā une décision antérieure11.
Au cours des derničres années, plusieurs audiences du Conseil ont mené ā des demandes de révision judiciaire devant la Cour fédérale et la Cour d’appel fédérale. Bien que ces révisions judiciaires donnent, en fin de compte, des précisions au Conseil et aux brevetés sur les principaux enjeux juridiques, ils sont trčs exigeants pour les ressources (financičres et humaines) du CEPMB. En janvier 2011, la Cour supręme du Canada a confirmé la décision du Conseil selon laquelle il a un droit de regard sur les produits médicamenteux brevetés vendus par l’intermédiaire du Programme d’accčs spécial de Santé Canada12. En date du 31 mars 2011, une seule décision du CEPMB a été portée devant la Cour fédérale; elle a rendu sa décision le 12 juillet 2011. En raison de la complexité inhérente ā la compétence du Conseil, on s’attend ā ce que les brevetés continuent de présenter des demandes devant la Cour fédérale et la Cour d’appel fédérale, dans des domaines oų la compétence du Conseil n’est pas clairement définie dans la loi et la jurisprudence.
Ā l’instar d’autres organismes de petite taille, le CEPMB arrive difficilement ā recruter et ā conserver des spécialistes d’expérience et ā embaucher du nouveau personnel de faįon opportune. En vue d’aborder ces difficultés, le CEPMB a harmonisé la planification de ses ressources humaines et celle de ses activités et, ce faisant, a pu continuer de répondre aux priorités opérationnelles et aux besoins en matičre de dotation. Le cadre intégré de planification des activités et des ressources humaines du CEPMB assure sur une base trimestrielle l’identification, l’examen et la documentation des exigences en matičre de ressources humaines ainsi que l’examen fréquent de l’état d’avancement des activités de dotation. Qui plus est, afin de pallier aux départs prévus du personnel chevronné ā la retraite, le CEPMB a établi que la planification de la relčve constituait une priorité clé en matičre de gestion pour l’exercice 2011-2012.
Sommaire du rendement
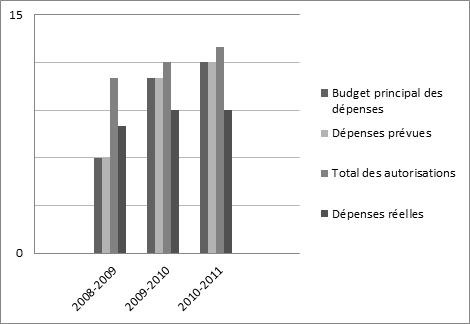
| Dépenses prévues | Total des autorisations | Dépenses réelles |
|---|---|---|
| 12 181,6 $ | 12 623,5 $ | 9 470,7 $* |
* L’écart entre le total des autorisations et les dépenses réelles est dû ā des fonds inutilisés de 2,3 millions de dollars provenant de l’affectation ā but spécial (ABS) et des fonds inutilisés en salaires en raison d’un effectif incomplet. L’ABS est réservée aux coûts relatifs aux audiences publiques, par exemple les conseillers juridiques externes, les témoins experts, etc. Les fonds non dépensés sont retournés au Trésor.
| Ressources prévues | Ressources réelles | Écart |
|---|---|---|
| 76,0 | 66,7 | 9,3* |
* L’écart entre les ressources prévues et les ressources réelles en ETP est dû aux retards encourus dans le recrutement d’experts professionnels, ā une augmentation du nombre d’employées en congé de maternité et ā une décision visant ā gérer le risque relatif aux augmentations des coûts en salaires en ne dotant pas certains postes.
| Indicateurs de rendement | Objectifs | Rendement de 2010-2011 |
|---|---|---|
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Rčglement. | Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci. |
En 2010, les prix au Canada dépassaient un peu la médiane des prix dans les pays de comparaison13. Vous trouverez de plus amples renseignements dans le graphique 12 de notre Rapport annuel 2010, Comparaison des prix pratiqués au Canada avec ceux pratiqués dans les pays de comparaison. |
| (en milliers de dollars) Activité de programme |
2009-2010 Dépenses réelles |
2010-11 | Concordance avec les résultats du gouvernement du Canada | |||
|---|---|---|---|---|---|---|
| Budget principal des dépenses | Dépenses prévues |
Autorisations totales14 |
Dépenses réelles |
|||
| Conformité et application de prix non excessifs pour les médicaments brevetés | 4 724,2 $ | 7 648,8 $ | 7 648,8 $ | 7 041,7 $ | 4 232,0 $ | Des Canadiens en santé |
| Rapports sur les tendances relatives aux produits pharmaceutiques | 670,7 | 1 624,8 | 1 624,8 | 1 307,9 | 890,4 | |
| Total | 5 394,9 $ | 9 273,6 $ | 9 273,6 $ | 8 349,6 $ | 5 122,4 $ | |
| Activité de programme | 2009-2010 Dépenses réelles |
2010-11 | |||
|---|---|---|---|---|---|
| Budget principal des dépenses | Dépenses prévues |
Autorisations totales15 |
Dépenses réelles |
||
| Services internes | 3 704,9 $ | 2 908,0 $ | 2 908,0 $ | 4 273,9 $ | 4 348,3 $ |
Profil des dépenses
Par le truchement de la présentation 834516 qui a reįu l’aval du Conseil du Trésor en septembre 2008, le CEPMB a été autorisé ā ajouter un item ā son Budget supplémentaire des dépenses (B) d’un montant de 4,7 millions de dollars (sans les RASE) qui s’ajoute aux 5,8 millions de dollars du budget de services votés afin de lui permettre de poursuivre ses activités essentielles pour le bon exercice de son mandat. Les niveaux de référence du crédit 35 (Dépenses de programme) ont été majorés de 5,6 millions de dollars pour 2009-2010, de 6,2 millions de dollars pour 2010-2011 et de 5,8 millions de dollars pour 2011-2012 et exercices suivants (y compris les RASE, mais excluant le loyer versé ā Travaux publics et Services gouvernementaux Canada).
Le financement du CEPMBcomprend une affectation ā but spécial (ABS) pour mener des audiences publiques, dans le crédit 35 (Dépenses du programme) de 3,1 millions de dollars. L’ABS peut uniquement ętre utilisée pour couvrir les coûts associés aux audiences publiques comme le recours ā des conseillers juridiques, ā des témoins experts, etc. Tout montant non utilisé pour la fin prévue doit ętre retourné au Trésor.
Pour l’exercice 2010-2011, le CEPMBfait rapport de dépenses totalisant 9,5 millions de dollars. Le nombre d’audiences n’a pas été aussi élevé que prévu, et ce, en partie en raison de la présentation d’engagements de conformité volontaire. Par conséquent, le CEPMB possčde 2,3 millions de dollars en fonds inutilisés de l’ABS.
En outre, le CEPMB possčde 0,7 million de dollars de fonds inutilisés dans son budget d’exploitation, ce qui ne comprend pas le montant de 0,3 million de dollars de dépenses de salaires pour lesquelles on a demandé aux organisations de gérer sa trésorerie ā la suite de la dissolution du Parlement. Le CEPMB a pu inclure ce montant dans le calcul du report prospectif de son budget d’exploitation. Le total des fonds inutilisés de 1,0 million de dollars était dû ā des postes vacants, ā certains postes dotés tardivement au cours de l’exercice et ā un nombre accru d’employées en congé de maternité.
Tendance en matičre de dépenses ministérielles (en millions de dollars)
Budget des dépenses par crédit voté
Pour obtenir plus de renseignements sur nos crédits organisationnels et/ou dépenses législatives, veuillez consulter les Comptes publics du Canada 2010-2011 (Volume II). Vous trouverez la version électronique de ce document au : http://www.tpsgc-pwgsc.gc.ca/recgen/txt/72-fra.html.
Section II : Analyse des activités de programme par résultat stratégique
Légende sur l’état du rendement
Dépassée : Plus de la totalité du niveau de rendement attendu (prouvé par l’indicateur et l’objectif, ou par les activités prévues et les extrants) par rapport au résultat attendu ou la priorité précisée dans le RPP a été atteinte au cours de l’exercice.
Entičrement atteinte : La totalité du niveau de rendement attendu (prouvé par l’indicateur et l’objectif, ou par les activités prévues et les extrants) par rapport au résultat attendu ou la priorité précisée dans le RPP a été atteinte au cours de l’exercice.
Atteinte en grande partie : De 80 ā 99 p. 100 du niveau de rendement attendu (prouvé par l’indicateur et l’objectif, ou par les activités prévues et les extrants) par rapport au résultat attendu ou la priorité précisée dans le RPP a été atteint au cours de l’exercice.
Passablement atteinte : De 60 ā 79 p. 100 du niveau de rendement attendu (prouvé par l’indicateur et l’objectif, ou par les activités prévues et les extrants) par rapport au résultat attendu ou la priorité précisée dans le RPP a été atteint au cours de l’exercice.
Non atteinte : Moins de 60 p. 100 du niveau de rendement attendu (prouvé par l’indicateur et l’objectif, ou par les activités prévues et les extrants) par rapport au résultat attendu ou la priorité précisée dans le RPP a été atteint au cours de l’exercice.
Résultat stratégique
Les médicaments brevetés ne peuvent ętre vendus au Canada ā des prix excessifs afin de protéger les intéręts de la population canadienne et leur régime de soins de santé. La population canadienne est également tenue informée des tendances de l’industrie.
Activité de programme 1
Conformité et application de prix non excessifs pour les médicaments brevetés
Description de l’activité de programme 1
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) exerce un contrôle sur les prix des médicaments brevetés vendus par les détenteurs de brevets au Canada pour usage humain ou pour usage vétérinaire. Au titre de cette activité de programme, le CEPMB passe en revue les prix demandés par les brevetés pour leurs médicaments brevetés en fonction des facteurs d’examen des prix prévus dans la Loi sur les brevets afin de s’assurer que ces prix ne sont pas excessifs. Lorsque, ā l’issue d’une audience publique, il apparaît que le prix d’un médicament est excessif sur un marché canadien, le Conseil peut rendre une ordonnance obligeant le breveté ā réduire le prix de son médicament et ā prendre les mesures qui lui sont dictées pour rembourser les recettes excessives qu’il a tirées de la vente de son médicament ā des prix excessifs.
| Dépenses prévues |
Total des autorisations16 |
Dépenses réelles |
|---|---|---|
| 7 648,8 $ | 7 041,7 $ | 4 232,0 $ |
| Ressources prévues | Ressources réelles | Écart |
|---|---|---|
| 44,0 | 37,0 | 7,0 |
| Résultats attendus de l’activité de programme | Indicateurs de rendement |
Objectifs | État du rendement |
|---|---|---|---|
|
Selon les facteurs mentionnés dans la Loi sur les brevets, les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs. |
Pourcentage des médicaments brevetés qui sont jugés conformes aux Lignes directrices |
Les prix de 95 p. 100 des médicaments brevetés jugés conformes aux Lignes directrices |
Atteinte en grande partie |
Sommaire du rendement et analyse de l’activité de programme 1
Selon la Politique de conformité et d’application, le Conseil était tenu d’établir des critčres qui justifient la tenue d’une enquęte. Ces critčres établissent un juste équilibre entre la latitude accordée aux brevetés au niveau de la fixation des prix de leurs produits médicamenteux et l’obligation du CEPMB de protéger les intéręts des consommateurs en veillant ā ce que les produits médicamenteux brevetés ne soient pas vendus au Canada ā des prix excessifs. Conformément ā l’annexe 5 de l’ancien Compendium – Critčres justifiant la tenue d’une enquęte17, le prix d’un produit médicamenteux breveté est considéré comme conforme aux Lignes directrices lorsqu’aucun critčre ne justifie la tenue d’une enquęte sur son prix.
Avec l’adoption des Lignes directrices révisées, on en a profité pour ajouter la Politique appliquée lorsque le prix semble excessif. En résumé, la politique stipule que, si le prix fixé par le breveté est plus élevé que le prix moyen maximal potentiel ou que le prix moyen non excessif national, mais dans une mesure trop minime pour justifier une enquęte18, une mention sera faite sur le site Web du CEPMB que le prix du produit médicamenteux breveté Ŧ ne justifie pas la tenue d’une enquęte ŧ plutôt qu'il n'est pas Ŧ conforme aux Lignes directrices ŧ comme par le passé.
Étant donné ce changement, il s’avčre difficile d’établir un rapport sur cet indicateur de rendement. En vertu des Lignes directrices révisées, les prix de seulement 79,8 p. 100 des médicaments brevetés sont jugés conformes aux Lignes directrices. Toutefois, en vertu des anciennes Lignes directrices, les prix de 91 p. 100 des médicaments brevetés en 2010 sont jugés conformes aux Lignes directrices, par rapport ā 89,5 p. 100 en 2009.
En somme, les deux calculs donnent lieu ā un état du rendement de Ŧ Atteinte en grande partie ŧ.
Leįons apprises
Męme si les deux calculs donnent lieu ā un état du rendement de Ŧ Atteinte en grande partie ŧ, l’écart entre les taux de conformité est important. Par conséquent, le CEPMB devra examiner ses objectifs pour cet indicateur en 2011-2012.
Activité de programme 2:
Rapports sur les tendances relatives aux produits pharmaceutiques
Description de l’activité de programme 2
Au titre de cette activité de programme, le CEPMB analyse les tendances en matičre de prix des produits pharmaceutiques ainsi que les dépenses en recherche-développement effectuées par les détenteurs de brevets pharmaceutiques. Il effectue également des analyses essentielles des tendances des prix des médicaments distribués sous ordonnance, de l’utilisation faite de ces médicaments et des coûts qu’ils occasionnent et collige de l’information sur les prix des médicaments non brevetés distribués sous ordonnance. Dans le rapport annuel au Parlement qu’il soumet par l’intermédiaire du ministre de la Santé, le CEPMB fait rapport de ces études analytiques, des résultats de ses examens des prix des médicaments et de ses activités d’application de la loi relativement aux prix excessifs pour les médicaments brevetés.
| Dépenses prévues |
Total des autorisations19 |
Dépenses réelles |
|---|---|---|
| $1 624,8 | 1 307,9 $ | 890,4 $ |
| Ressources prévues | Ressources réelles | Écart |
|---|---|---|
| 13,0 | 7,4 | 5,6 |
| Résultats attendus de l’activité de programme | Indicateurs de rendement | Objectifs | État du rendement |
|---|---|---|---|
|
Les intervenants sont mieux informés des tendances des prix des produits pharmaceutiques et des facteurs ā l’origine de l’augmentation des coûts en médicaments. |
Nombre de demandes de publications du CEPMB reįues Nombre de présentations faites par le CEPMB ā l’extérieur du Conseil |
Par rapport ā l’exercice précédent, augmentation de 5 p. 100 du nombre de demandes de publication 10 activités par année |
Voir Ŧ Leįons apprises ŧ (page 23) Dépassée |
Sommaire du rendement et analyse de l’activité de programme 2
Toutes les publications du CEPMB, y compris les études, les décisions du Conseil et les documents de référence, sont accessibles sur le site Web du CEPMB. Le CEPMB a axé ses efforts sur l’augmentation de la visibilité de son site Web, grâce ā un examen approfondi et ā une mise ā jour de l’architecture du site et de son contenu. Cet examen a donné lieu ā la mise en place d’un systčme de suivi aux fins de mesurer l’accčs aux pages Web, en vue d’adopter une approche plus ciblée ā l’égard des changements apportés. On présentera cette nouvelle architecture ā la haute direction, aux fins d’approbation, au début de l’exercice 2011-2012; les améliorations sont en cours et on prévoit que le nouveau site sera lancé en septembre 2011. Le fait de posséder un site Web plus convivial, ainsi que la mise en œuvre de la nouvelle stratégie d’engagement des intervenants de l’extérieur de l’industrie, amélioreront les activités de communication externe du CEPMB, en plus d’accroître la sensibilisation du public envers son rôle et ses activités générales, notamment en ce qui concerne les tendances de l’industrie pharmaceutique et les facteurs ā l’origine des coûts en médicaments.
En outre, le CEPMB a accéléré la publication de ses rapports et études en vertu du Systčme national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Le 15 décembre 2010, le CEPMB a publié quatre nouveaux rapports analytiques:
- Application de la dose quotidienne définie par l’Organisation mondiale de la santé dans les analyses de l’utilisation et des coûts des médicaments au Canada (PDF)
- Effet des baby-boomers sur les dépenses en médicaments d’ordonnance et les demandes de remboursement (PDF)
- Médicaments génériques au Canada : Structure de marché — Tendances et répercussions (PDF)
- Médicaments génériques au Canada : Tendances des prix et comparaisons des prix internationaux, 2007(PDF)
Ces rapports et ceux qui suivront contribueront ā la prise de décisions éclairées dans le domaine pharmaceutique.
En 2010-2011, le CEPMB a pris part ā 20 activités externes, qui s’adressaient ā différents auditoires, y compris les principaux intervenants du CEPMB, les brevetés, les provinces et les territoires, les tiers payants et les groupes de défense des intéręts des patients. Le CEPMB a également exploré de nouveaux médias, y compris la vidéoconférence et les webinaires, dans le but d’atteindre un plus grand nombre d’intervenants.
Leįons apprises
Les intervenants se fient beaucoup au site Web du CEPMB pour trouver des renseignements; il attire en moyenne 13 000 visiteurs mensuellement. On s’attend ā ce que les demandes de publications imprimées continuent de diminuer en raison de leur accessibilité sur le site Web. Par conséquent, on devra examiner cet indicateur dans un avenir rapproché.
Activité de programme 3
Services internes
Description de l'activité de programme 3
Les services internes regroupent des activités et des ressources connexes qui sont gérées de faįon ā répondre aux besoins des programmes et des autres obligations générales d’une organisation. Ces groupes sont les suivants : services de gestion et de surveillance, services des communications, services juridiques, services de gestion des ressources humaines, services de gestion des finances, services de gestion de l’information, services des technologies de l’information, services de gestion des biens, services de gestion du matériel, services de gestion des acquisitions et services de gestion des voyages et autres services administratifs. Les services internes comprennent uniquement les activités et les ressources destinées ā l’ensemble d’une organisation et non celles fournies ā un programme particulier.
| Dépenses prévues |
Total des autorisations20 |
Dépenses réelles |
|---|---|---|
| 2 908,0 $ | 4 198,3 $ | 4 348,3 $ |
| Ressources prévues | Ressources réelles | Écart |
|---|---|---|
| 19,0 | 22,3 | (3,3) |
Sommaire du rendement et analyse de l’activité de programme 3
Cette activité de programme était encore largement consacrée aux activités courantes dont l’objet est de soutenir la prestation du programme. Les faits saillants de l’activité de programme des services internes au cours de la période de planification comprennent ce qui suit :
- la nouvelle conception continue de la base de données sur la conformité contenant les renseignements sur les prix des produits médicamenteux au soutien des fonctions de conformité et d’exécution du CEPMB;
- la nomination par gouverneur en conseil des membres du Conseil afin de doter les postes de président et de vice-président;
- l’achčvement d’un examen des politiques sur la gestion de l’information du gouvernement du Canada, la formation du personnel sur la gestion de l’information et le choix de nouveaux systčmes logiciels pour l’aider ā gérer les rapports d’entreprise;
- la mise au point et l’approbation d’un cadre de stratégie de mesure du rendement des activités de programme du CEPMB, y compris un cadre d’évaluation des programmes pour le programme d’analyse des tendances relatives aux produits pharmaceutiques.
Section III : Renseignements supplémentaires
Principales données financičres
| Écart en pourcentage | 2010-2011 | 2009–2010 | |
|---|---|---|---|
| Total de l'actif | (284,7 %) | 884,3 $ | 3 402,0 $ |
| Total du passif | (95,9 %) | 2 359,6 $ | 4 622,3 $ |
| Avoir du Canada | 17,3 % | (1 475,5 $) | (1 220,2 $) |
| (284,7 %) | 884,3 $ | 3 402,0 $ |
| Écart en pourcentage | 2010-2011 | 2009–2010 | |
|---|---|---|---|
| Total des dépenses | 6,4 % | 10 900,8 $ | 10 205,8 $ |
| Total des revenus | (4,0 %) | 23 272,6 $ | 24 204,6 $ |
| Coût de fonctionnement | (12,4 %) | (12 237,8 $) | (13 908,8 $) |
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a commencé l’exercice financier 2010-2011 avec un financement stable ā la mesure de la charge de travail envisagée.
L’attention a été essentiellement portée aux activités importantes telles que t la tenue d’un plus grand nombre d’examens de prix, d’enquętes et d’audiences qui sont par ailleurs devenus plus complexes, ainsi que la mise en œuvre et la surveillance continues de l’application et des répercussions des principales modifications apportées aux Lignes directrices.
Des efforts ont également été investis dans la refonte de la base de données essentielle. La nouvelle base de données est actuellement en phase d’essais rigoureux et les employés ont suivi une formation ā ce sujet.
Les principales données financičres présentées dans ce rapport ministériel sur le rendement fournissent un aperįu général de la situation financičre du CEPMB et de ses activités.
États financiers
Vous trouverez les états financiers du Conseil sur le site Web du CEPMB au http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=118.
Liste de tableaux supplémentaires
Tous les tableaux de renseignements supplémentaires en version électronique du Rapport ministériel sur le rendement 2010-2011 sont affichés sur le site Web du Secrétariat du Conseil du Trésor du Canada, ā l’adresse: http://www.tbs-sct.gc.ca/dpr-rmr/2010-2011/index-fra.asp.
- Sources de revenus disponibles et non disponibles
- Achats écologiques
- Évaluations ā venir au cours des trois prochains exercices
Section IV : Autres Sujets D’intéręt
Coordonnées de l’organisme
Le Conseil d’examen du prix des médicaments brevetés
Boîte L40
Centre Standard Life
333, avenue Laurier ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone: (613) 952-7360
1 877 861-2350
Télécopieur: (613) 952-7626
ATMT: (613) 957-4373
Courriel: pmprb@pmprb-cepmb.gc.ca
Site Web: www.pmprb-cepmb.gc.ca
Renseignements supplémentaires
Rapport annuel 2010 du CEPMB http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=91
Publication trimestrielle La Nouvelle (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=287&mp=68)
Guide du breveté (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=146)
Compendium des politiques, des Lignes directrices et des procédures (en vigueur le 1er janvier 2010) http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1206&mp=808
Compendium des Lignes directrices, politiques et procédures (mars 2008)
(http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1034)
Loi sur les brevets (http://laws-lois.justice.gc.ca/fra/lois/P-4/index.html)
Rčglement sur les médicaments brevetés (http://laws-lois.justice.gc.ca/fra/reglements/DORS-94-688/index.html)
1On définit les priorités de type 1 comme suit : Déjā établie : établie durant le premier ou le second exercice avant l’année visée par le rapport; Continue : établie durant au moins trois exercices avant l’année visée par le rapport; Nouvelle : nouvellement établie dans l’année du RMR.
2Avril 2010 – Ŧ Comparaison du prix selon la catégorie thérapeutique internationale ŧ;
Octobre 2010 – Ŧ Directive du Conseil concernant l’application des Lignes directrices de 2010 en lien avec sa Politique sur l’utilisation des produits médicamenteux brevetés et non brevetés dans les tests appliqués aux prix ŧ; sous
Ŧ Lignes directrices – Mise ā jour ŧ;
Octobre 2010 – Ŧ Clarification du remboursement des recettes excessives ŧ; sous Ŧ Lignes directrices – Mise ā jour ŧ;
Janvier 2011 – Ŧ Produits médicamenteux existants vendus subséquemment par un autre breveté ŧ
3On a organisé des séances de sensibilisation ā Montréal et Toronto, en mars 2011, auxquelles 72 brevetés et consultants ont participé.
4On peut trouver de plus amples renseignements sur les Lignes directrices, particuličrement sur la Méthodologie de la majoration et les Examens du prix Ŧ sur un marché ŧ dans les annexes 10 et 12 du Compendium des politiques, des Lignes directrices et des procédures, respectivement.
5Le CEPMB a organisé un webinaire, en avril 2011, afin de présenter les recommandations du groupe de travail sur la méthodologie de la majoration aux intervenants intéressés.
6Avec l’adoption des modifications de 1987 apportées ā la Loi, l’association Les compagnies de recherche pharmaceutique du Canada (Rx&D) s’est engagée publiquement ā augmenter ses dépenses annuelles en R-D pour atteindre 10 p. 100 des recettes tirées des ventes avant 1996, selon l'étude d'impact de la réglementation (RÉIA) du Rčglement sur les médicaments brevetés, 1988, publiée dans la partie II de la Gazette du Canada, vol. 122, No 20 – SOR/DORS/88-474.
7Le Comité directeur du SNIUMP est formé de représentants des régimes publics d’assurance‑médicaments (toutes les provinces hormis le Québec) et de Santé Canada.
8Parmi les intervenants extérieurs ā l’industrie, notons : les groupes de défense des consommateurs, les groupes de défense des droits des patients, les groupes ou associations de maladies ou des soins de santé, les professionnels de la santé et leurs associations, les ministres provinciaux et territoriaux de la Santé, les régimes publics d’assurance-médicaments, les tiers payants et les universitaires.
9Le groupe de travail a présenté son rapport final au Conseil durant sa réunion trimestrielle, le 4 mars 2011; on peut le consulter sur le site Web du CEPMB, www.pmprb-cepmb.gc.ca, sous la rubrique Consultations, groupe de travail sur la méthodologie de la majoration.
10On peut trouver de plus amples renseignements sur les Lignes directrices, particuličrement sur la méthodologie de la majoration, dans l'annexe 10 du Compendium des politiques, des Lignes directrices et des procédures. On peut consulter le Compendium ā partir du site Web du CEPMB, au www.pmprb-cepmb.gc.ca, sous la rubrique Loi, Rčglement et Lignes directrices.
11Pour obtenir de plus amples renseignements sur les audiences et les décisions du Conseil, consultez la section Ŧ Engagements de conformité volontaire et audiences ŧ du Rapport annuel 2010, accessible sur le site Web du CEPMB : www.pmprb-cepmb.gc.ca.
12Décision de la Cour supręme du Canada – Celgene Corporation c. Procureur général du Canada http://www.scc-csc.gc.ca/case-dossier/cms-%20sgd/sum-som-fra.aspx?cas=33579
13Ces chiffres s’appuient sur une moyenne arithmétique pondérée de la médiane des ratios des prix des pays de comparaison et du Canada.
14L’écart entre les dépenses prévues et le total des autorisations est dû au fait que toutes les dépenses de RASE étaient incluses dans le total des autorisations pour les services internes.
15Le total des autorisations pour les services internes comprennent les RASE dépensées pour la conformité et l’application de prix non excessifs pour les médicaments brevetés de 606 900 $, les programmes de rapports sur les tendances relatives aux produits pharmaceutiques de 316 900 $ et le montant de report prospectif de 393 400 $.
16L’écart entre les dépenses prévues et le total des autorisations est dû au fait que toutes les dépenses de RASE étaient incluses dans le total des autorisations pour les services internes.
17Pour obtenir de plus amples renseignements sur les Critčres justifiant la tenue d’une enquęte sur le prix du produit médicamenteux breveté, ā compter du 1er janvier 2010, consulter l’annexe 5 du Compendium des politiques, des Lignes directrices et des procédures Ŧ jusqu’ā 2009 ŧ.
18Pour obtenir de plus amples renseignements sur la Politique appliquée lorsque le prix semble excessif, consulter le paragraphe B.5 de la Partie B – Politiques du Compendium des politiques, des Lignes directrices et des procédures, juin 2009
19L’écart entre les dépenses prévues et le total des autorisations est dû au fait que toutes les dépenses de RASE étaient incluses dans le total des autorisations pour les services internes.
20Le total des autorisations pour les services internes comprennent les RASE dépensées pour la conformité et l’application de prix non excessifs pour les médicaments brevetés de 606 900 $, les programmes de rapports sur les tendances relatives aux produits pharmaceutiques de 316 900 $ et le montant de report prospectif d’environ 393 400 $.