ARCHIVÃ - Conseil d'examen du prix des mÃĐdicaments brevetÃĐs Canada
 Cette page a ÃĐtÃĐ archivÃĐe.
Cette page a ÃĐtÃĐ archivÃĐe.
Information archivÃĐe dans le Web
Information archivÃĐe dans le Web à  des fins de consultation, de recherche ou de tenue de documents. Cette derniÃĻre nâa aucunement ÃĐtÃĐ modifiÃĐe ni mise à  jour depuis sa date de mise en archive. Les pages archivÃĐes dans le Web ne sont pas assujetties aux normes qui sâappliquent aux sites Web du gouvernement du Canada. ConformÃĐment à  la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à  la page ÂŦ Contactez-nous Âŧ.
2008-2009
Rapport ministÃĐriel sur le rendement
Conseil d'examen du prix des mÃĐdicaments brevetÃĐs Canada
La version originale a ÃĐtÃĐ signÃĐe par
L'honorable Leona Aglukkaq
Ministre de la SantÃĐ
Table des matières
Résultat stratégique et l’Architecture des activités de programme
- Ressources financières
- Ressources humaines
- Sommaire du rendement
- Contribution des priorités à l’atteinte des résultats stratégiques
Postes votés et postes législatifs
Section 2 - Analyse des activités de programme par résultat stratégique
Section 3 - Renseignements supplémentaires
Principales données financières
Liste des tableaux supplémentaires
Message du Président
C’est avec plaisir que je vous présente le Rapport sur les plans et les priorités de 2008-2009 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, le Conseil est investi d’un double mandat, à savoir d’un mandat de réglementation et d’un mandat de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs. En vertu de son mandat de rapport, le CEPMB fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement au Canada. Le CEPMB contribue également d’une façon générale à l’amélioration de la condition de santé de la population canadienne en protégeant les intérêts des consommateurs et du régime canadien de soins de santé. À cette fin, il s’assure que les produits médicamenteux brevetés ne sont pas vendus à des prix excessifs et tente dans toute la mesure du possible d’éclairer le processus de prise de décisions.
En 2008, 1 260 produits médicamenteux brevetés étaient assujettis à la compétence du Conseil. De ce nombre, 78 étaient nouveaux et l’objet d’un premier rapport au Conseil.
La capacité du CEPMB de bien s’acquitter de son mandat de réglementation dépend de la pertinence et de l’efficacité de ses Lignes directrices sur les prix excessifs (Lignes directrices) et de sa capacité de tenir des audiences lorsque telle avenue s’impose.
En 2005, le Conseil a engagé l’examen de ses Lignes directrices sur les prix excessifs et, à cette fin, a consulté ses principaux intervenants comme le prévoit la Loi sur les brevets. En 2008-2009, le processus a avancé d’une façon importante avec la publication de deux Avis et commentaires sur les modifications proposées aux Lignes directrices. La dernière ronde de consultations s’est déroulée au printemps 2009. Les Lignes directrices ont été publiées en juin 2009 et leur date d’entrée en vigueur a été fixée au 1er janvier 2010. Des séances d’information sont actuellement offertes et l’incidence des modifications apportées au Règlement est évaluée sur une base constante.
En 2008, le Conseil a émis quatre Avis d’audience, nommément dans l’affaire de Apotex pour défaut de soumettre son rapport et dans l’affaire concernant le prix de vente de son médicament Apo-Salvent exempt de CFC; et dans l’affaire de ratiopharm Inc. pour défaut de soumettre son rapport et dans l’affaire du prix de son médicament ratio-Salbutamol HFA. Le 16 mars 2009, le Conseil a émis un autre Avis d’audience, celui-là dans l’affaire d’Amgen Canada Inc. et du prix de son médicament Neulasta.
Afin que le Conseil dispose des ressources requises pour bien exercer son mandat de réglementation, le Conseil du Trésor a, le 4 septembre 2008, autorisé l’octroi de crédits supplémentaires au CEPMB. Grâce à ces nouvelles ressources, le CEPMB disposera des moyens nécessaires pour bien mettre en œuvre ses Lignes directrices révisées et pour en faire le suivi, pour tenir des séances d’information à l’intention des brevetés et autres intervenants, pour effectuer ses examens de prix et mener s’il y a lieu des enquêtes dans des délais raisonnables et pour tenir des audiences si nécessaire.
En 2008-2009, le CEPMB a continué d’effectuer des analyses et de publier des rapports de ses conclusions au titre du Système national d’information sur les médicaments prescrits (SNIUMP) et ce, en consultation avec les régimes fédéraux, provinciaux et territoriaux d’assurance-médicaments participants et en collaboration avec l’Institut canadien d’information sur la santé (ICIS).
Le CEPMB ne ménage aucun effort pour bien exercer son mandat de réglementation et de rapport. Il continue également d’exercer une surveillance vigilante de l’évolution de l’environnement pharmaceutique pour ainsi être en mesure d’adapter la façon dont il s’acquitte de son mandat.
Brien G. Benoit, MD
Président
Section 1 — Survol du Conseil
Raison d'être
Le mandat du Conseil d’examen du prix des médicaments brevetés (CEPMB) comporte les deux volets suivants :
Réglementation — Veiller à ce que les prix auxquels les brevetés vendent leurs produits médicamenteux brevetés au Canada ne soient pas excessifs.
Rapport — Faire rapport sur les tendances des prix des produits médicamenteux ainsi que sur les dépenses des brevetés dans la R-D au Canada.
Responsabilités
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi judiciaires. Il a été créé par le Parlement en 1987 en vertu des révisions apportées à la Loi sur les brevets (projet de loi C-22). En 1993, la Loi a été modifiée à nouveau (projet de loi C-91). Ces révisions avaient pour but d’adapter la Loi aux changements que le gouvernement avait apportés au régime de gestion des brevets pharmaceutiques.
Réglementation
Le CEPMB vérifie les prix auxquels les brevetés vendent leurs produits médicamenteux brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre aux grossistes, aux hôpitaux, aux pharmacies et autres clients canadiens et veille à ce que ces prix ne soient pas excessifs. Le CEPMB réglemente le prix de chaque médicament breveté, plus précisément de chaque concentration de chaque forme posologique de chaque produit médicamenteux breveté offert sur le marché canadien. C’est généralement à ce niveau que Santé Canada attribue le numéro d’identification de drogue (DIN) en vertu du processus d’attribution de l’Avis de conformité.
La Cour d’appel fédérale a déterminé les conditions où, légalement, un brevet est lié à un médicament. De l’avis de la Cour, il doit exister entre le brevet et le médicament « un lien si tenu soit-il », ce qui suppose une application assez vaste de la compétence du Conseil. La compétence du Conseil s’applique aux produits médicamenteux dont le brevet porte sur son ingrédient actif, mais également aux produits médicamenteux auxquels un brevet est lié, que ce brevet porte sur un procédé de fabrication, un mode d’administration, une forme posologique, l’indication/utilisation, la préparation ou autre. Les produits médicamenteux brevetés ne sont pas nécessairement non plus des produits de marque. En effet, certains fabricants de produits génériques sont assujettis à la compétence du Conseil du fait qu’ils vendent en vertu d’une licence d’exploitation le même produit que le produit de marque ou, encore, qu’ils sont titulaires d’un brevet visant le procédé de conditionnement ou de traitement de produits.
Le CEPMB n’est pas habilité à réglementer les prix des produits médicamenteux non brevetés. Il n’a aucun droit de regard sur les prix de vente au gros et au détail des produits médicamenteux brevetés et non brevetés ni sur les honoraires des pharmaciens. La distribution, l’ordonnance et le remboursement des médicaments ne relèvent pas non plus de sa compétence.
En vertu du Règlement sur les médicaments brevetés, les brevetés doivent informer le CEPMB de leur intention de vendre un nouveau produit médicamenteux breveté sur le marché canadien. Après leur première vente, les brevetés doivent faire rapport au CEPMB du prix de vente de leur produit médicamenteux et de la quantité vendue. Par la suite, pour chaque semestre, ils doivent faire rapport des prix et des ventes au Canada des différentes concentrations de leurs produits médicamenteux aux fins de la réglementation de leurs prix.
Même s’ils ne sont pas tenus de faire approuver au préalable les prix de vente de leurs produits médicamenteux, les brevetés doivent respecter à la lettre les dispositions de la Loi pour que les prix de vente au Canada de leurs produits médicamenteux brevetés ne soient pas excessifs. Lorsque, à l’issue d’une audience publique, il apparaît que le prix d’un médicament vendu sur un marché canadien est excessif, le Conseil peut rendre une ordonnance qui oblige le breveté à réduire le prix de son médicament et à appliquer les mesures qui lui sont dictées pour rembourser les recettes excessives encaissées.
Rapport
Le CEPMB rend annuellement compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur l’année civile terminée, présente également une analyse des tendances des prix de tous les médicaments et fait rapport des dépenses de R-D des brevetés au Canada. Par ailleurs, en vertu de l’article 90 de la Loi,le ministre de la Santé a confié deux responsabilités additionnelles au CEPMB, à savoir le Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) et les suivi et rapport des tendances des prix des médicaments non brevetés distribués sous ordonnance.
Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP)
Depuis 2001, en vertu d’une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé, le CEPMB effectue des recherches au titre du SNIUMP. Le SNIUMP a pour fonction de produire des analyses critiques des prix des médicaments distribués sous ordonnance, de l’utilisation faite de ces médicaments et des tendances observées au niveau de leurs coûts et d’en fournir les résultats au régime canadien de soins de santé pour améliorer sa compréhension de la façon dont les médicaments d’ordonnance sont utilisés au Canada et des facteurs d’augmentation des coûts.
Prix des médicaments non brevetés distribués sous ordonnance
En 2005, intervenant aux noms des ministres fédéral, provinciaux et territoriaux de la Santé, le ministre de Santé Canada a chargé le CEPMB d’exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Les ministres de la Santé souhaitaient ainsi constituer une source d’information centralisée de données fiables sur les prix de ces médicaments. Depuis avril 2008, les études sur les prix des médicaments non brevetés distribués sous ordonnance sont effectuées au titre du SNIUMP.
Résultat stratégique et l’Architecture des activités de programme
Le CEPMB compte un résultat stratégique (RS) et deux activités de programme (AP) — à savoir la réglementation et les rapports. Ce résultat et ces activités sont illustrés dans le graphique présenté ci-après.

Conformité et pratique de prix non excessifs pour les médicaments brevetés
Le CEPMB exerce un contrôle sur les prix des médicaments brevetés vendus par les détenteurs de brevets au Canada pour usage humain ou pour usage vétérinaire aux grossistes, aux hôpitaux, aux pharmacies et autres clients. Au titre de cette activité de programme, le CEPMB passe en revue les prix demandés par les brevetés pour leurs médicaments brevetés en fonction des facteurs d'examen des prix prévus dans la Loi sur les brevets afin de s'assurer que ces prix ne sont pas excessifs. Lorsque, à l'issue d'une audience publique, il apparaît que le prix d'un médicament est excessif sur un marché, le Conseil peut rendre une ordonnance obligeant le breveté à réduire le prix de son médicament et à prendre les mesures qui lui sont dictées pour rembourser les recettes excessives qu'il a tirées de la vente de son médicament à des prix excessifs.
Tendances relatives aux produits pharmaceutiques
Au titre de cette activité de programme, le Conseil d'examen du prix des médicaments brevetés (CEPMB) analyse les tendances en matière de prix des produits pharmaceutiques ainsi que les dépenses en recherche-développement effectuées par les détenteurs de brevets pharmaceutiques. Il effectue également des analyses essentielles des tendances des prix des médicaments distribués sous ordonnance, de l'utilisation faite de ces médicaments et des coûts qu'ils occasionnent et collige de l'information sur les prix des médicaments non brevetés distribués sous ordonnance. Dans son rapport annuel au Parlement qu'il soumet par l'intermédiaire du ministre de la Santé et dans différentes études spéciales, le CEPMB fait rapport de l'information qu'il collige, des résultats de ses examens des prix des médicaments et de ses activités d'application de prix non excessifs pour les médicaments brevetés.
Sommaire — Rendement
| Dépenses prévues | Total des autorisations | Dépenses réelles |
|---|---|---|
| 5 842,0 $ | 11 159,6 $ | 8 050,2 $ |
| Ressources prévues | Ressources réelles | Écart |
|---|---|---|
| 46.0 | 49.0 | (3.0) |
Le 4 septembre 2008, le CEPMB a reçu confirmation du Conseil du Trésor que des ressources additionnelles lui avaient été consenties pour lui permettre de continuer de bien exercer son mandat de réglementation. En conséquence, une partie importante (4,7 millions de dollars) des dépenses autorisées ont été reportées à février 2009, soit jusqu’à ce que soit approuvé le Budget supplémentaire des dépenses (B). Le Conseil a essentiellement affecté ses dépenses aux grandes activités de révision de ses Lignes directrices sur les prix excessifs et aux activités courantes d’examen de prix, d’enquêtes et d’audiences.
En ce qui concerne les ETP, le CEPMB a engagé le processus de dotation de postes clés après avoir obtenu le 4 septembre 2008 confirmation de l’approbation de crédits supplémentaires. Le processus de dotation était encore cours à la fin de l’exercice financier et a débordé dans le nouvel exercice.
Sommaire du rendement
| Résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également tenue informée des tendances de l'industrie pharmaceutique. | ||
|---|---|---|
| Indicateurs de rendement | Objectifs | Rendement de 2008-2009 |
| Au Canada, les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement. | Au Canada, les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement. | En 2008, les prix au Canada dépassaient légèrement la médiane de leurs prix de vente dans les sept pays de comparaison. Vous trouverez de plus amples renseignements dans le graphique 12 de notre rapport annuel 2008 (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=91&mp=68) |
| Activité de programme | 2007-2008 Dépenses réelles |
2008-2009 | Concordance avec les résultats du gouvernement du Canada | |||
|---|---|---|---|---|---|---|
| Budget principal des dépenses | Dépenses prévues | Total des autorisations | Dépenses réelles | |||
| AP 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés | 5 706,5 $ | 3 194,0 $ | 3 194,0 $ | 7 955,0 $ | 5 263,1 $ | Des Canadiens en santé : veiller à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs.. |
| AP 2 : Tendances relatives aux produits pharmaceutiques | 1 725,9 $ | 2 648,0 $ | 2 648,0 $ | 3 204,6 $ | 2 787,1 $ | Des Canadiens en santé :
|
| Total | 7 432,4 $ | 5 842,0 $ | 5 842,0 $ | 11 159,6 $ | 8 050,2 $ | |
Du budget total de la première AP, la somme de 2,2 millions de dollars a fait l’objet d’une affectation à but spécial qui doit être utilisée pour couvrir les coûts d’audience. De ce montant, la somme de 1,4 million de dollars n’était plus disponible en 2008-2009 du fait que certaines affaires faisant l’objet d’une audience ont contre toute attente été réglées au moyen d’un Engagement de conformité volontaire et que d’autres qui devaient faire l’objet d’une audience ont été reportées pour permettre plus ample négociation avec le breveté. L’autre écart (première et deuxième AP) est attribuable aux délais de dotation de postes nouveaux et existants.
Contribution des priorités à l’atteinte des résultats stratégiques
| Priorités opérationnelles | Type | Progrès accompl | Liens avec le résultat stratégique1 |
|---|---|---|---|
| Révision des Lignes directrices | Permanente | Satisfait à presque toutes les attentes La toute dernière ronde de consultations a commencé en mars 2009. La version définitive des Lignes directrices révisées a été publiée le 9 juin 2009. Les Lignes directrices révisées doivent entrer en vigueur le 1er janvier 2010. |
Les Lignes directrices révisées rendent le processus d’examen du prix plus transparent, plus juste et ses résultats plus prévisibles, ce qui aide les brevetés à fixer les prix de leurs produits médicamenteux brevetés à un niveau qui ne devrait pas être jugé excessif. Les Lignes directrices révisées sont plus faciles à comprendre et permettent une plus grande latitude dans des situations d’exception, ce qui devrait favoriser la conformité des brevetés en vertu de la Loi. |
| Les nouvelles Lignes directrices facilitent la conformité volontaire. | Déjà établie | Satisfait à presque toutes les attentes Les prix de 87 % des produits médicamenteux brevetés ont été jugés conformes aux Lignes directrices du Conseil. |
Les brevetés ne vendant pas leurs produits médicamenteux à des prix considérés excessifs, l’accès aux produits médicamenteux brevetés est devenu plus abordable pour les Canadiens et pour le régime canadien de soins de santé. |
| Les examens des prix des médicaments brevetés sont effectués dans des délais raisonnables | Permanente | Satisfait à toutes les attentes 95 % des produits médicamenteux brevetés lancés sur le marché en 2008 ont été soumis en 2008 à l’examen du prix, de manière à déterminer si le prix est ou non conforme aux Lignes directrices. De même, les prix de 99 % des produits médicamenteux existants ont été vérifiés en 2008. |
En améliorant le délai d’examen des prix d’un produit médicamenteux breveté, le Conseil protège les intérêts des consommateurs. |
| Priorités en matière de gestion | Type | Progrès accompli | Liens avec le résultat stratégique |
|---|---|---|---|
| Obtenir un financement permanent des activités du Conseil plus généreux qui tiendrait compte d’un accroissement de ses activités de réglementation et de ses fonctions administratives. | Nouvelle | Satisfait à toutes les attentes Le 4 septembre 2008, le Conseil du Trésor a pour l’exercice 2009-2010 majoré de 4,7 millions de dollars (excluant le régime d’avantages sociaux des employés) notre Budget supplémentaire des dépenses (B) et de 5,6 millions de dollars les niveaux de référence du crédit 35 (Dépenses du programme). |
Ce financement additionnel a permis au CEPMB de s’adjoindre les ressources nécessaires pour bien s’acquitter de son mandat de réglementation qui est de s’assurer que les produits médicamenteux brevetés ne sont pas vendus au Canada à des prix excessifs, et ce, dans les intérêts des Canadiens. |
Analyse des risques
Le CEPMB a déjà fait état des risques d’un sous-financement de ses activités de réglementation advenant un nombre record d’enquêtes et d’audiences sur les prix excessifs des médicaments et du besoin de mettre à jour et de moderniser ses Lignes directrices sur les prix excessifs afin qu’elles soient encore pertinentes et efficaces.
En 2008-2009, le CEPMB a obtenu une majoration permanente de son financement à la hauteur de 4,7 millions de dollars (excluant le régime d’avantages sociaux des employés). Ces crédits supplémentaires ont réduit le risque que le CEPMB manque des ressources requises pour lui permettre de bien s’acquitter de son mandat de réglementation, mais actuellement c’est au niveau de la dotation des nouveaux postes que le CEPMB connaît certaines difficultés.
En ce qui a trait à la révision des Lignes directrices, son organisation s’est révélée un défi de taille en raison du nombre et de la diversité des points de vue exprimés par les différents intervenants sur les questions soumises à la consultation. Cependant, grâce aux vastes consultations menées auprès des intervenants -- dont l’industrie pharmaceutique, les gouvernements et les groupes de défense des intérêts des consommateurs/patients -- les Lignes directrices révisées sont aujourd’hui plus claires, plus transparentes et plus pertinentes pour l’environnement pharmaceutique moderne.
Le Conseil a publié la version révisée de ses Lignes directrices en juin 2009, mais celles-ci n’entreront en vigueur que le 1er janvier prochain. Au nombre des stratégies visant à réduire les risques associés à l’opérationalisation des Lignes directrices révisées, citons une communication de grande ampleur avec les brevetés et les autres intervenants au moyen de séances de breffage/d’information et de présentations.
En 2008-2009, plusieurs décisions et ordonnances rendues par le Conseil ont fait l’objet de requêtes en révision judiciaire.
Le 25 févier 2008 un panel d’audience du Conseil a rendu une décision avec ses motifs dans l’affaire de Teva Neuroscience et du prix de son nouveau médicament Copaxone et a rendu son ordonnance le 12 mai 2008. Teva Neuroscience a répliqué en déposant une requête en révision judiciaire auprès de la Cour fédérale. La date à laquelle cette requête sera entendue n’a pas encore été fixée.
Dans une décision datée du 21 janvier 2008, le Conseil a confirmé sa compétence sur le prix du médicament Thalomid, un médicament distribué au Canada au titre du Programme d’accès spécial de Santé Canada. Celgene Corporation a déposé une requête en révision judiciaire de la décision dans le but d’infirmer la compétence du Conseil en ce qui concerne le prix de son médicament Thalomid. Dans une décision qu’elle a rendue le 17 mars 2009, la Cour fédérale a rejeté la décision du Conseil. Le procureur général du Canada a interjeté appel de la décision de la Cour fédérale auprès de la Cour d’appel fédérale. La date d’audience de cet appel n’est pas encore connue.
Dans la foulée de la publication, en août 2008, d’un Communiqué faisant état de l’obligation des brevetés de faire rapport au Conseil des avantages qu’ils consentent à leurs clients en application du Règlement sur les médicaments brevetés, Rx&D et al et Pfizer Canada Inc. ont déposé des requêtes en révision judiciaire. La Cour fédérale a entendu ces requêtes en juin 2009 et a rendu sa décision le 10 juillet suivant dans laquelle elle annulait l’obligation imposée aux brevetés de tenir compte des avantages consentis à des tiers dans le calcul des prix moyens nets de leurs médicaments. Le procureur général du Canada n’a pas encore communiqué son intention d’interjeter ou non appel de cette décision.
La Loi permet aux brevetés de demander que les décisions du Conseil fassent l’objet de révisions judiciaires, ce qui représente un risque continu pour le Conseil. Toutefois, par suite des décisions de la Cour fédérale, les affaires concernant l’interprétation que fait le Conseil du mandat dont l’investit la Loi se trouvent révisées et clarifiées, en bout de ligne pour le plus grand bénéfice du Conseil et des brevetés.
Profil des dépenses
Considérant les pressions de plus en plus grandes qui s’exercent sur sa charge de travail, le CEPMB a obtenu pour les exercices 2006-2007 et 2007-2008 des crédits pour l’intégrité de son programme.
En prévision de l’échéance de ce financement temporaire à la fin du mois de mars 2008, le CEPMB a préparé une demande de financement motivée dans laquelle il faisait état des pressions toujours plus grandes exercées sur sa charge de travail et ses besoins en ressources. En septembre 2008, le Conseil du Trésor a donné au CEPMB l’autorisation d’inclure dans son Budget supplémentaire des dépenses (B) un poste de 4,7 millions de dollars (excluant le régime d’avantages sociaux des employés) (en plus des 5,8 millions de dollars consentis au titre des services votés), afin de lui permettre de faire face à sa charge de travail et de poursuivre ses activités aux fins de l’exercice de son mandat.
Le CEPMB a également été autorisé à majorer de 1,9 million de dollars son affectation à but spécial de 2008-2009 pour le financement des audiences publiques et ce, au titre du crédit 35 (Dépenses du programme). Cette affectation à but spécial ne pouvait être utilisée que pour couvrir les coûts des audiences publiques.
En 2008-2009, le CEPMB a déclaré des dépenses totalisant 8,1 millions de dollars.
Le CEPMB n’a pas réussi à utiliser 1,4 million de dollars de son affectation à but spécial qui lui a été consentie du fait que certaines audiences ont, contre toute attente, pris fin après présentation d’un engagement de conformité volontaire en vertu desquels les différents brevetés se sont engagés à réduire le prix de leur produit médicamenteux et à rembourser les recettes excessives tirées de la vente à un prix excessif. De même, d’autres affaires qui auraient probablement fait l’objet d’un Avis d’audience ont été reportées. Il est difficile prévoir avec justesse les coûts des audiences pour l’année du fait qu’il est impossible de déterminer à l’avance le nombre d’affaires qui justifieront la tenue d’une audience et que les coûts d’audiences varient d’étape en étape (par ex. les coûts associés à la conférence préparatoire sont moins élevés que ceux des audiences sur le fond pour lesquelles différents témoins sont appelés à la barre).
L’incertitude du moment où les crédits supplémentaires allaient être reçus explique également dans une certaine mesure pourquoi les crédits n’ont pas été pleinement utilisés. Cette incertitude a contribué au défi qui se pose à de petits organismes comme le CEPMB en ce qui touche le recrutement des ressources humaines et la conservation de l’effectif.
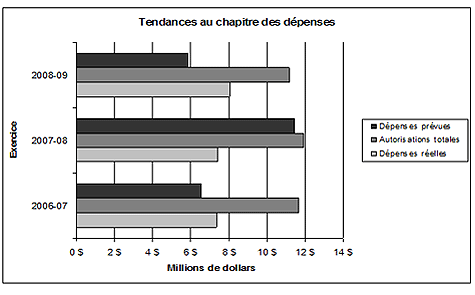
Postes votés et postes législatifs (en milliers de dollars)
| Poste voté ou législatif (L) | Libellé tronqué du poste voté ou législatif | 2006-2007 Dépenses réelles | 2007-2008 Dépenses réelles | 2008-2009 Budget principal des dépenses | 2008-2009 Dépenses réelles |
|---|---|---|---|---|---|
| 35 | Dépenses du Programme | 6 742,5 $ | 6 722,5 $ | 5 211,0 $ | 7 385,9 $ |
| (L) | Contributions aux régimes d’avantages sociaux des employés | 622,8 $ | 709,9 $ | 631,0 $ | 664,3 $ |
| Total pour le CEPMB | 7 365,3 $ | 7 432,4 $ | 5 742,0 $ | 8 050,2 $ | |
L’augmentation des dépenses de l’exercice 2008-2009 par rapport à l’exercice 2007-2008 est essentiellement attribuable à d’importants travaux de rénovation effectués dans les bureaux du CEPMB ainsi qu’à des améliorations majeures de la base de données, modifications impératives à l’exécution du mandat. Ces deux projets ont été financés avec les crédits supplémentaires obtenus dans le Budget supplémentaire des dépenses (B). Ces augmentations ont été partiellement compensées par des économies réalisées en raison de postes nouveaux et existants non comblés.
Section 2 —Analyse des activités de programme par résultat stratégique
Résultat stratégique
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) compte un seul résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également tenue informée des tendances de l’industrie pharmaceutique.
L’indicateur de performance de ce résultat stratégique est le suivant : Au Canada les prix des médicaments brevetés se situent dans la fourchette de leurs prix de vente dans les sept pays de comparaison nommés dans le Règlement.
L’objectif de ce résultat stratégique est formulé comme suit : Au Canada, les prix des médicaments brevetés se situent au niveau de la médiane de leurs prix dans les différents pays de comparaison ou sous celle-ci.
Le résultat stratégique repose sur les deux activités de programme suivantes :
1. Conformité et pratique de prix non excessifs pour les médicaments brevetés ;
2.Tendances relatives aux produits pharmaceutiques
Activités de programme
| Activité de programme 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés | |||||
|---|---|---|---|---|---|
| Ressources financières 2008-2009 (milliers de dollars) | Ressources humaines 2008-2009 (ETP) | ||||
| Dépenses prévues | Total des authorisations | Dépenses réelles | Ressources prévues | Ressources réelles | Écart |
| 3 194,0 $ | 7 955,0 $ | 5 263,1 $ | 25,5 | 33,0 | (7,5) |
| Résultats attendus | Indicateurs de rendement | Objectifs | État du rendement | Sommaire du rendement |
|---|---|---|---|---|
| Selon les facteurs mentionnés dans la Loi sur les brevets,les prix auxquels les brevetés vendent leurs médicaments brevetés au Canada ne sont pas excessifs. | Pourcentage des médicaments brevetés qui sont jugés conformes aux Lignes directrices | Les prix de 95 % des médicaments brevetés sont jugés conformes aux Lignes directrices | Satisfait à presque toutes les attentes | Les prix de 87 % % de tous les médicaments brevetés assujettis ā la compétence du Conseil ont été jugés conformes aux Lignes directrices. |
Avantages pour les Canadiens
Le CEPMB veille à ce que les produits médicamenteux brevetés ne soient pas vendus au Canada à des prix excessifs, contribuant ainsi à la protection des intérêts des consommateurs canadiens et du régime canadien de soins de santé.
Analyse du rendement
En 2008, le personnel du Conseil a complété l’examen des prix de 99 % de tous les produits médicamenteux brevetés vendus au Canada afin de s’assurer qu’ils se situent dans les limites autorisées par les Lignes directrices du Conseil. Les prix de 87 % des 1 260 produits médicamenteux brevetés assujettis à la compétence du Conseil ont été jugés non excessifs. Par ailleurs, les prix de 10 % de ces produits ont justifié une enquête et de 2 %, une audience du Conseil. Les prix de 1 % des produits étaient encore sous examen. Le CEPMB a observé depuis quelques années un recul au niveau du taux général de conformité des prix des produits médicamenteux brevetés (88 % en 2008 par rapport à 95 % en 2003 et en 2004), ce qui explique l’augmentation du nombre d’enquêtes sur les prix des produits médicamenteux brevetés et du nombre d’audiences du Conseil. Par exemple, entre le 1er janvier 2008 et le 31 mars 2009, le CEPMB a émis cinq Avis d’audience. Au cours de la même période, il a approuvé neuf engagements de conformité volontaire2 dont deux se rapportaient à des produits médicamenteux visés par un Avis d’audience.
Étant donné que c’est essentiellement par le truchement des Lignes directrices du Conseil sur les prix excessifs que sont communiquées aux brevetés les interprétations du Conseil quant à l’approche et à la méthodologie qu’il suit pour bien s’acquitter de son mandat, le processus de révision des Lignes directrices prend tout son sens. Suite à de vastes consultations auprès des principaux intervenants et d’amples séances de travail du Conseil, les Lignes directrices révisées (publiées en juin 2009, mais dont l’entrée en vigueur a été fixée au 1er janvier 2010) rendent le processus d’examen des prix plus clair et plus transparent. Elles autorisent également une plus grande souplesse pour des situations d’exception qui pourraient se produire dans l’environnement pharmaceutique que nous connaissons. Le CEPMB effectuera l’évaluation de l’application et de l’incidence des changements apportés à ses Lignes directrices. Le Conseil espère que les Lignes directrices révisées aideront les brevetés à mieux se conformer à ses Lignes directrices.
Leçons apprises
La volonté et la capacité des brevetés de se conformer aux Lignes directrices du Conseil sur les prix excessifs subissent l’influence de l’environnement pharmaceutique et industriel dans son ensemble. Dans le cours de son processus de révision de ses Lignes directrices, le CEPMB a fait valoir qu’un moins grand nombre de médicaments vedettes ou constituant une découverte ont été lancés sur le marché au cours des dernières années. Par ailleurs, le marché a enregistré une augmentation du nombre de médicaments existants améliorés qui, sans nécessairement être plus efficaces, offrent d’autres bienfaits thérapeutiques. Une tendance se dessine également vers une plus grande uniformisation des prix à l’échelle du monde. Ces récentes tendances ont été soulignées dans le cours du processus de révision des Lignes directrices et ont d’ailleurs suscité des points de vue intéressants de la part des intervenants. Le Conseil estime que les Lignes directrices révisées sont plus pertinentes que les anciennes en ce sens qu’elles reconnaissent l’influence de certaines de ces tendances, mais également qu’elles prévoient divers scénarios de prix des médicaments.
| Activité de programme 2 : Tendances relatives aux produits pharmaceutiques | |||||
|---|---|---|---|---|---|
| Ressources financières 2008-2009 (milliers de dollars) | Ressources humaines 2008-2009 (ETP) | ||||
| Dépenses prévues | Total des authorisations | Dépenses réelles | Ressources prévues | Ressources réelles | Écart |
| 2 648,0 $ | 3 204,6 $ | 2 787,1 $ | 20,5 | 16,0 | 4,5 |
| Résultats attendus | Indicateurs de rendement | Objectifs | État du rendement | Sommaire du rendement |
|---|---|---|---|---|
| Les intervenants sont mieux informés des tendances des prix des produits pharmaceutiques et des facteurs à l‘origine de l’augmentation des coûts en médicaments. | Nombre de demandes de publications reçues Nombre d’activités auxquelles participe le CEPMB |
Par rapport à l’exercice précédent, augmentation de 5 % du nombre de demandes de publications 10 activités par année |
Satisfait à presque tous Satisfait à tous |
Un engagement de conformité volontaire est un engagement écrit par lequel le breveté s’engage à réduire le prix de son médicament pour le rendre conforme aux Lignes directrices sur les prix excessifs et à rembourser les recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif. En 2008-2009, le CEPMB a participé à 14 activités organisées à l’externe. |
Avantages pour les Canadiens
Les analyses que le CEPMB fait au titre du Système national d’information sur les médicaments prescrits (SNIUMP) des tendances de prix des produits médicamenteux d’ordonnance, de l’utilisation faite de ces médicaments et de leurs coûts aident essentiellement les gestionnaires des régimes publics d’assurance-médicaments (à l’exception du Québec, toutes les provinces et tous les territoires participent au SNIUMP) à prévoir et à gérer les coûts en médicaments et à établir leurs politiques. Ainsi, les gestionnaires des différents régimes d’assurance-médicaments peuvent profiter de l’excellente capacité d’analyse du CEPMB et de ses rapports de grande qualité tout en évitant un dédoublement du travail dans un cas où ces études devraient être faites par chaque régime.
Analyse du rendement
Depuis quelques années, le nombre de demandes de publication est relativement stable. Toutefois, le CEPMB s’est attaché à améliorer la visibilité de son site Web dans lequel il affiche toutes ses publications. Il distribue également un bulletin d’information par voie électronique à ses abonnés. De plus, dans le contexte de son initiative de révision de ses Lignes directrices sur les prix excessifs, les échanges réguliers avec les différents secteurs/groupes d’intervenants ont contribué à améliorer la visibilité du CEPMB, ce qui a donné lieu à une plus grande fréquentation du site.
En 2008-2009, le CEPMB a participé à 14 activités organisées à l’externe. Outre des présentations à deux conférences internationales, le CEPMB a eu l’occasion de faire des représentations auprès de différents auditoires, dont les brevetés, les provinces et les territoires, les tiers payeurs, les groupes de défense des intérêts des patients et des délégations étrangères, pour ne nommer que ceux-là.
Leçons apprises
De toute évidence, exclusion faite du rapport annuel du CEPMB, nos intervenants ont de plus en plus tendance à consulter notre site Web pour obtenir les renseignements qu’ils cherchent. Nous nous attendons donc à ce que le nombre de demandes de publications-papier demeure stable, sinon diminue au cours des prochaines années. En conséquence, pour la rubrique « Résultats escomptés » de la présente Activité du programme, le CEPMB réévaluera la pertinence et l’utilité des indicateurs de rendement et des objectifs.
Section 3 — Renseignements supplémentaires
Principales données financières
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a connu ses moments d’incertitude financière en 2008-2009 alors que son financement temporaire arrivait à échéance et qu’il était soumis à des pressions importantes quant à sa capacité de bien s’acquitter de son mandat. Le Conseil a réussi à obtenir un financement permanent qui tient compte des pressions à la hausse exercées sur sa charge de travail. De plus, en raison des délais d’attente avant l’approbation du financement demandé, le Conseil a dû concentrer ses ressources sur ses activités les plus importantes telles que la révision de ses Lignes directrices sur les prix excessifs, les examens du prix des médicaments brevetés, les enquêtes et les audiences du Conseil. Parallèlement, le CEPMB a pu investir dans l’amélioration de sa base de données, nécessaire à l’exécution de son mandat, et planifier les rénovations de ses bureaux afin d’aménager des espaces de travail pour les nouveaux ETP.
Les principales données financières présentées dans ce rapport ministériel sur le rendement fournissent un aperçu général de la situation financière du CEPMB et de ses activités. Vous trouverez les états financiers du Conseil dans notre site Web ( http://www.pmprb-cepmb.gc.ca).
(en milliers de dollars)
| Bilan financier résumé Pour la période terminée le 31 mars 2009 |
Écart en pourcentage | 2009 | 2008 |
|---|---|---|---|
| ACTIF Total de l’actif |
(98,9 %) | 10,4 $ | 971,3 $ |
| PASSIF Total du passif |
29,2 % | 2 068,9 $ | 1 601,1 $ |
| Capitaux propres Total des capitaux propres |
226,8 % | 2 058,5 $ | 629,8 $ |
| TOTAL | (98,9 %) | 10,4 $ | 971,3 $ |
(en milliers de dollars)
| État des résultats résumé Pour la période terminée le 31 mars 2009 |
Écart en pourcentage | 2009 | 2008 |
|---|---|---|---|
| DÉPENSES Total des dépenses |
11,3 % | 9 257,7 $ | 8 316,1 $ |
| REVENUS Total des revenus |
134,3 % | 24 760,0 $ | 10 566,6 $ |
| COÛT DE FONCTIONNEMENT | 588,8 % | (15 502,3 $) | (2 250,5 $) |
Liste des tableaux supplémentaires
Vous trouverez les tableaux suivants sur le site Web du Conseil du Trésor du Canada au http://www.tbs-sct.gc.ca/estsd-bddc/index-fra.asp
- Tableau 1 : Sources des revenus non disponibles
- Tableau 9 : Achats écologiques
Autres publications d’intérêt
Rapport annuel 2008 du CEPMB (http://www.pmprb-cepmb.gc.ca/francais/View.asp?x=91&mp=68)
La Nouvelle (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=287&mp=68)
Guide du breveté (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=146)
Compendium des Lignes directrices, politiques et procédures (mars 2008) (http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1034)
Compendium des politiques, des Lignes directrices et des procédures, juin 2009 (en vigueur le 1er janvier 2010) http://www.pmprb-cepmb.gc.ca/francais/view.asp?x=1206&mp=808
Loi sur les brevets (http://laws.justice.gc.ca/fr/showtdm/cs/P-4)
Règlement sur les médicaments brevetés (http://laws.justice.gc.ca/fr/showtdm/cr/DORS-94-688)
1. Les différentes priorités du CEPMB ont un lien avec l’objectif stratégique : « Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également tenue informée des tendances de l’industrie pharmaceutique. »
2. Un engagement de conformité volontaire est un engagement écrit dans lequel le breveté s’engage à réduire le prix de son produit médicamenteux breveté pour le rendre conforme aux Lignes directrices sur les prix excessifs et à rembourser les recettes excessives qu’il a tirées de la vente de son médicament à un prix excessif.