ARCHIVÉ - Conseil d'examen du prix des médicaments brevetés Canada
 Cette page a été archivée.
Cette page a été archivée.
Information archivée dans le Web
Information archivée dans le Web à des fins de consultation, de recherche ou de tenue de documents. Cette dernière n’a aucunement été modifiée ni mise à jour depuis sa date de mise en archive. Les pages archivées dans le Web ne sont pas assujetties aux normes qui s’appliquent aux sites Web du gouvernement du Canada. Conformément à la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à la page « Contactez-nous ».
2008-2009
Rapports sur les plans et priorités
Conseil d’examen du prix des médicaments brevetés
L'honorable Tony Clement
Ministre de la Santé et ministre de l’Initiative fédérale du développement économique dans le Nord de l’Ontario
Table des matières
- Message du président
- Déclaration de la direction
- Raison d’être
- Organigramme
- Concordance de l'architecture des activités du programme (AAP)
- Crédits votés et crédits législatifs figurant dans le Budget principal des dépenses
- Dépenses prévues et équivalents temps plein
- Renseignements sommaires
- Priorités du CEPMB
- Activités du programme par résultat stratégique rw fewrgcewgrcecece
- Plans et priorités du CEPMB
SECTION II – ANALYSE DES ACTIVITÉS DU PROGRAMME SELON LE RÉSULTAT STRATÉGIQUE
SECTION III – RENSEIGNEMENTS SUPPLÉMENTAIRES
SECTION I – SURVOL
Message du président
C’est avec plaisir que je vous présente le Rapport sur les plans et les priorités de 2008-2009 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, il est investi d’un double mandat, à savoir d’un mandat de réglementation et d’un mandat de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les prix des médicaments brevetés ne soient pas excessifs, protégeant ainsi les intérêts des consommateurs et contribuant au régime de soins de santé canadien. En vertu de son mandat de rapport, le CEPMB fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement au Canada, éclairant ainsi les processus de prise de décisions et d’élaboration des politiques. Le CEPMB contribue également à l’amélioration de la santé de la population canadienne en exigeant des brevetés qu’ils réduisent les prix de leurs médicaments brevetés lorsque ceux-ci sont jugés excessifs et en atténuant les pressions qu’exercent les coûts en médicaments sur notre régime de soins de santé.
Depuis sa création, le CEPMB a réussi dans une large mesure à exercer son mandat en tenant un nombre relativement restreint d’audiences publiques. Il en a été ainsi non pas parce que le CEPMB n’appliquait pas la Loi avec diligence, mais plutôt en raison de l’efficacité des Lignes directrices du Conseil sur les prix excessifs et de notre Politique de conformité volontaire. En 2005-2006, dans l’exercice de son mandat de réglementation, le CEPMB a pressenti une augmentation marquée du nombre d’enquêtes et d’audiences sur les prix de médicaments brevetés et conclu que le moment était venu de réviser ses Lignes directrices sur les prix excessifs. Pour combler les besoins pressants et atténuer les pressions qui s’exercent, le CEPMB a obtenu des crédits supplémentaires de 5 millions de dollars pour l’exercice 2006-2007 et la même somme pour l’exercice 2007-2008. La mesure dans laquelle le CEPMB réussit à bien exercer son mandat dépend de sa capacité de tenir des audiences lorsque celles-ci se révèlent nécessaires ainsi que de la pertinence et de l’efficacité de ses Lignes directrices. Au cours des dernières années, le nombre d’audiences du Conseil a augmenté tout comme leur complexité. Depuis janvier 2006 seulement, le Conseil a engagé neuf audiences par opposition à huit pour la période de 1987 à 2005.
Nos Lignes directrices existent dans leur forme actuelle depuis 1994. Des initiatives récentes, telle que la Loi de 2006 sur un régime de médicaments transparents pour les patients (Ontario), les modifications à la Loi sur l’assurance-médicaments et modifiant diverses dispositions législatives (Québec, 2005) et la Stratégie nationale sur les produits pharmaceutiques adoptée par les gouvernements fédéral, provinciaux et territoriaux, ont fait braquer les projecteurs sur les prix des médicaments et sur les tendances des coûts en médicaments. Parallèlement, le CEPMB a prêté une oreille attentive aux préoccupations de ses intervenants concernant les prix de lancement élevés des nouveaux médicaments et autres sujets. Afin d’atténuer ces préoccupations, le Conseil a entrepris un processus de révision de ses Lignes directrices et ce, en consultation avec ses intervenants comme l’exige la Loi sur les brevets. À la lumière des réponses obtenues, le Conseil a effectué une analyse en profondeur et tenu des séances de consultation. Il a continué d’évaluer les modifications aux Lignes directrices suggérées et mène en parallèle des consultations bilatérales avec l’industrie, les gouvernements et les consommateurs afin que la révision des Lignes directrices soit complétée à l’automne 2008. Par ailleurs, une décision de la Cour fédérale rendue en mars 2007 nous laisse craindre que, dans leur forme actuelle, le Règlement sur les médicaments brevetés, 1994 (le Règlement) et les Lignes directrices amènent les brevetés à cesser d’offrir différents avantages aux consommateurs. Le CEPMB évalue actuellement les mesures qui pourraient être mises en oeuvre pour régler la situation. Lorsque des décisions auront été prises et mises en œuvre, un suivi sera exercé en permanence et les ajustements requis seront apportés pour s’assurer que les Lignes directrices sont pertinentes et efficaces dans le contexte de l’environnement pharmaceutique actuel et que le processus d’examen du prix demeure transparent et prévisible.
En 2001, le ministre de la Santé a demandé au CEPMB d’effectuer, en collaboration avec l’Institut canadien d’information sur la santé (ICIS) et les régimes F-P-T d’assurance-médicaments participants, des analyses des prix des médicaments et de faire rapport des tendances observées et ce, au titre du Système national d’information sur les médicaments prescrits (SNIUMP). Par ses analyses critiques des tendances des prix des médicaments, de l’utilisation faite des médicaments et des coûts, le CEPMB fournit au régime canadien de soins de santé des renseignements complets, judicieux et utiles sur les tendances des prix des médicaments distribués sous ordonnance et sur les facteurs d’augmentation des coûts en médicaments.
En octobre 2005, dans le cadre de la Stratégie nationale sur les produits pharmaceutiques, le CEPMB a été chargé par le ministre fédéral de la Santé de faire le suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. À compter de l’exercice 2008-2009, ce suivi et ces rapports seront effectués au titre du SNIUMP.
Enfin, le CEPMB continue d’exercer son mandat avec équité et transparence.

Brien G. Benoit, M.D.
Président
Déclaration de la direction
Je soumets, aux fins de son dépôt au Parlement, le Rapport sur les plans et les priorités (RPP) de 2008-2009 du Conseil d’examen du prix des médicaments brevetés.
Le présent document a été préparé conformément aux principes de présentation des rapports énoncés dans le Guide de préparation de la Partie III du Budget des dépenses 2008-2009 : Rapports sur les plans et les priorités et Rapports ministériels sur le rendement.
- Il est conforme aux exigences précises de déclaration figurant dans les lignes directrices du Secrétariat du Conseil du Trésor;
- Il repose sur les résultats stratégiques et l’architecture des activités de programme du ministère qui ont été approuvés par le Conseil du Trésor;
- Il présente une information cohérente, complète, équilibrée et fiable;
- Il fournit une base pour la reddition de comptes à l’égard des résultats obtenus avec les ressources et les autorisations qui lui sont confiées;
- Il rend compte de la situation financière en fonction des chiffres des dépenses prévues approuvés provenant du Secrétariat du Conseil du Trésor du Canada.

Nom : Brien G. Benoit, MD
Titre : Président
Raison d’être
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est investi d’un double mandat :
|
Réglementation – Veiller à ce que les prix auxquels les fabricants vendent leurs médicaments brevetés ne soient pas excessifs, protégeant ainsi les intérêts des consommateurs et contribuant au système de santé canadien. Rapport – Faire rapport sur les tendances de l’industrie pharmaceutique ainsi que sur les dépenses que les brevetés engagent dans la R-D au Canada, éclairant ainsi les processus de prise de décisions et d’élaboration des politiques. |
Organigramme
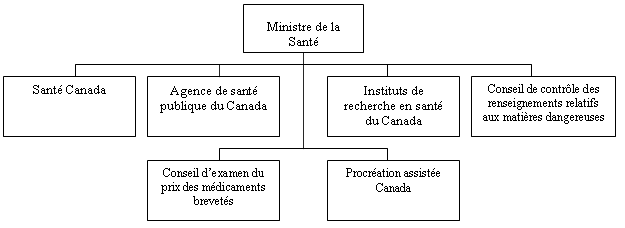
Portefeuille de la Santé
Le ministre de la Santé est chargé de maintenir et d’améliorer la santé des Canadiens et des Canadiennes. Il reçoit le soutien du portefeuille de la Santé qui comprend Santé Canada, l’Agence de santé publique du Canada, les Instituts de recherche en santé du Canada, le Conseil de contrôle des renseignements relatifs aux matières dangereuses, le Conseil d’examen du prix des médicaments brevetés et Procréation assistée Canada. Chaque membre du portefeuille prépare son propre Rapport sur les plans et priorités. Le portefeuille de la Santé se compose d’environ 12 000 employés équivalant temps plein et dispose d’un budget annuel de plus de 3,8 milliards de dollars.
Le Conseil d’examen du prix des médicaments brevetés
Le ministre de la Santé veille à la bonne application des dispositions de la Loi sur les brevets relatives aux médicaments (articles 79 à 103 de la Loi) et, comme l’exige la Loi, fait rapport au Parlement des activités du CEPMB par le truchement du Rapport sur les plans et les priorités, du Rapport sur la performance du ministère et du Rapport annuel du CEPMB. C’est également le ministre de la Santé qui recommande au gouverneur en conseil la nomination des membres du Conseil ainsi que les modifications qu’il y aurait lieu d’apporter aux Règlements sur les médicaments brevetés, 1994. Le ministre peut aussi demander au Conseil de mener des enquêtes en vertu de l’article 90 de la Loi sur les brevets.
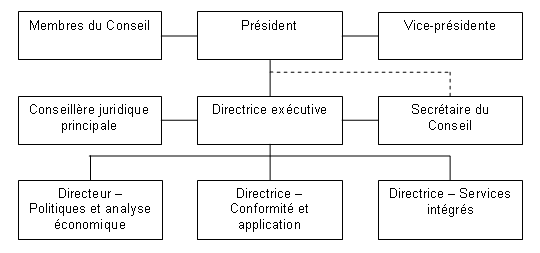
Le Conseil est formé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Les nominations au Conseil sont faites par le gouverneur en conseil. En juin 2006, le Dr Benoit, alors vice-président du Conseil, a été nommé président du Conseil et Mme Mary Catherine Lindberg a été nommée membre et vice-présidente pour un mandat de cinq ans. En mars 2007, Mme Anne Warner LaForest a été nommée membre du Conseil pour un mandat de cinq ans. M. Anthony Boardman a été reconduit dans ses fonctions pour un deuxième mandat en 2005 et M. Thomas (Tim) Armstrong, en 2007.
Aux termes de la Loi sur les brevets , le président du Conseil est également le premier dirigeant du CEPMB et, à ce titre, supervise et dirige les activités du Conseil. Pour sa part, la directrice exécutive dirige le travail du personnel. Les cadres supérieurs du CEPMB sont la directrice exécutive, la directrice - Conformité et application, le directeur - Politiques et analyse économique, la directrice - Services intégrés, la secrétaire du Conseil et la conseillère juridique principale.
La Direction de la conformité et de l’application est en grande partie responsable de l’examen du prix des médicaments brevetés ainsi que de l’application de la politique de conformité et d’application. La Direction des politiques et de l’analyse économique est responsable de la conduite des analyses de politiques, de la préparation des rapports sur les tendances des prix des médicaments et autres études économiques ainsi que de la prestation de conseils stratégiques. Le Secrétariat du Conseil, la Direction des services intégrés et les Services juridiques s’occupent respectivement des communications, de l’administration et du soutien juridique. De plus, le Secrétariat assure un soutien aux membres du Conseil dans l’exercice de leurs fonctions et gère le processus d’audience.
Concordance de l’architecture des activités du programme (AAP)
|
2008-2009 |
|||
|
Nouvelles activités du programme |
|||
|
(en milliers de dollars) |
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
Tendances de l’industrie pharmaceutique |
Total |
|
Examen du prix des médicaments brevetés |
3 194,0 |
2 648,0 |
5 842,0 |
En raison de ce changement, l’architecture des activités du programme compte désormais les deux rôles mentionnés dans la Loi sur les brevets, à savoir « réglementation » et « rapport ».
Crédits votés et crédits législatifs figurant dans le Budget principal des dépenses
|
Crédit voté ou législatif |
Libellé tronqué pour le crédit voté ou législatif |
Budget principal |
Budget principal |
|
35 |
Dépenses du Programme |
5 211,0 |
10 584,0 |
|
(S) |
Contributions aux régimes des avantages sociaux des employés |
631,0 |
891,0 |
|
|
Total pour le CEPMB |
5 842,0 |
11 475,0 |
Le Budget principal des dépenses pour 2008-2009 a été révisé à la baisse pour les raisons suivantes : 1) échéance du financement additionnel de 5 millions consentis en 2007-2008 dans le Budget principal des dépenses aux fins de la tenue d’audiences publiques et de la révision des Lignes directrices sur les prix excessifs; 2) nouveau protocole d’accord intervenu entre le CEPMB et Santé Canada aux fins du financement des activités du CEPMB au titre du Système national d’information sur les médicaments brevetés (SNIUMP), le financement passant ainsi de 1,350 million de dollars qu’il était à 850 millions de dollars (le financement de 560 000 $ pour les rapports sur les prix des médicaments non brevetés distribués sous ordonnance est maintenu, mais il s’inscrit désormais sous le poste du SNIUMP); et 3) réduction de 200 000 $ du financement consenti par Santé Canada pour l’initiative sur l’amélioration du processus d’examen des prix du CEPMB s’inscrivant dans la Stratégie d’accès aux produits thérapeutiques (SAPT).
Dépenses prévues et équivalents temps plein
|
(en milliers de dollars) |
Prévisions des dépenses |
Dépenses prévues |
Dépenses prévues |
Dépenses prévues |
|
Examen du prix des médicaments brevetés |
11 475,0 |
- |
- |
- |
|
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
- |
3 194,0 |
3 194,0 |
3 194,0 |
|
Tendances de l’industrie pharmaceutique |
- |
2 648,0 |
2 648,0 |
2 648,0 |
|
Estimé principal des dépenses (montant brut) |
11 475,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Moins : Revenus disponibles |
- |
- |
- |
- |
|
Total des dépenses prévues |
11 475,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Rajustements : |
|
|
|
|
|
Économies au niveau des approvisionnements |
|
|
|
|
|
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
- |
- |
- |
- |
|
Tendances de l’industrie pharmaceutique |
- |
- |
- |
- |
|
Autres |
|
|
|
|
|
Crédit 15 du Conseil du Trésor |
42,0 |
|
|
|
|
Régime d’avantages sociaux des employés (RASE) |
8,0 |
|
|
|
|
Total des rajustements |
50,0 |
|
|
|
|
Total des dépenses prévues |
11 525,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Moins : Revenus non disponibles1 |
(9 478,5) |
- |
- |
- |
|
Plus : Valeur des services reçus à titre gracieux 2 |
981,4 |
835,5 |
824,0 |
824,4 |
|
Total des dépenses du CEPMB |
3 027,9 |
6 677,5 |
6 666,0 |
6 666,4 |
|
Équivalents temps plein |
62,0 |
46,0 |
46,0 |
46,0 |
Renseignements sommaires
|
20082009 |
2009-2010 |
2010-2011 |
|
5 842,0 |
5 842,0 |
5 842,0 |
|
2008-2009 |
2009-2010 |
2010-2011 |
|
46,0 |
46,0 |
46,0 |
Priorités du CEPMB
|
Nom |
Type |
|
1. Conformité et pratique de prix non excessifs pour les médicaments brevetés |
En cours |
|
2. Tendances de l’industrie pharmaceutique |
En cours |
Activités du programme par résultat stratégique
|
|
|
Dépenses prévues |
|
||
|
|
Résultats escomptés |
2008-2009 |
2009-2010 |
2010-2011 |
Contribue à la priorité suivante |
|
Résultat stratégique : |
Les médicaments brevetés ne sont pas vendus à des prix excessifs au Canada et ce, pour les meilleurs intérêts de la population canadienne et du régime de soins de santé. Les Canadiens sont aussi mieux renseignés sur les tendances de l’industrie pharmaceutique . |
|
|||
|
Activité du programme no 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés |
Les brevetés vendent leurs médicaments brevetés au Canada à des prix jugés non excessifs à la lumière des facteurs mentionnés dans la Loi sur les brevets |
3 194,0 |
3 194,0 |
3 194,0 |
Priorité no 1 |
|
Activité du programme no 2 : Tendances de l’industrie pharmaceutique |
Les intervenants sont mieux renseignés sur les tendances de l’industrie pharmaceutique et sur facteurs d’augmentation des coûts en médicaments |
2 648,0 |
2 648,0 |
2 648,0 |
Priorité no 2 |
Plans et priorités du CEPMB
Priorité 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 à la suite de la révision de la Loi sur les brevets (projet de loi C-22) qui a accru la protection assurée aux brevets liés à des produits pharmaceutiques. Le CEPMB constitue la composante stratégique de la politique des brevets du gouvernement fédéral dont l’objet est de protéger les intérêts des consommateurs et de contenir les coûts des soins de santé en contrepartie de nouvelles mesures visant à protéger la propriété intellectuelle.
Le CEPMB exerce un contrôle sur les prix « départ-usine » , à savoir sur les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés aux grossistes, aux hôpitaux, aux pharmacies ou à d’autres clients, afin qu’ils ne soient pas excessifs. Ces médicaments sont pour un usage humain ou pour usage vétérinaire et sont distribués sous ordonnance ou en vente libre.3
Le personnel du Conseil fait l’examen des prix de tous les médicaments brevetés vendus au Canada pour en vérifier la conformité aux Lignes directrices sur les prix excessifs (Lignes directrices).4 S’il arrive à la conclusion que le prix d’un médicament breveté semble non conforme aux Lignes directrices et que les critères justifiant la tenue d’une enquête sont réunis, le personnel du Conseil ouvre une enquête pour déterminer si le prix du médicament est effectivement supérieur au prix autorisé en vertu des Lignes directrices.5 Les résultats de l’enquête peuvent être les suivants :
- fin de l’enquête lorsqu’il est établi que le prix est conforme aux Lignes directrices; ou
- engagement de conformité volontaire en vertu duquel le breveté s’engage à réduire le prix de son médicament et à rembourser la partie excessive des recettes qu’il a tirées de la vente de son médicament à un prix excessif; ou
- recommandation faite au président du Conseil qu’il est dans l’intérêt du public de tenir une audience publique pour déterminer si le prix du médicament est ou non excessif et, le cas échéant, de décider de l’ordonnance corrective qu’il y a lieu de rendre.
La mesure dans laquelle le CEPMB exerce bien son mandat dépend de sa capacité de tenir les audiences nécessaires et de s’assurer que ses Lignes directrices demeurent pertinentes et efficaces. Les audiences du Conseil sont devenues au cours des dernières années plus complexes, mais aussi plus nombreuses. À preuve, le Conseil a engagé 9 audiences depuis janvier 2006 alors qu’il n’en avait engagées que 8 entre 1987 et 2005. Au cours des prochaines années, des pressions devraient continuer de s’exercer sur la capacité du CEPMB de bien exercer le mandat qui lui est conféré par la Loi.
En 2005, en application de la Loi sur les brevets, le CEPMB a engagé un dialogue avec ses intervenants (industrie, gouvernements F-P-T, consommateurs et autres) à l’aide de son document de discussion qui portait l’intitulé « Document de discussion : Augmentations des prix des médicaments brevetés ». En mai 2006, le CEPMB a répété l’expérience en publiant le « Guide de discussion aux fins de consultation sur les Lignes directrices du Conseil sur les prix excessifs », lequel s’intéressait plus particulièrement au prix de lancement des nouveaux médicaments. Le CEPMB a analysé les réponses reçues et, à l’automne 2006, a convié ses intervenants à des séances de consultation. En 2007, il a poursuivi son analyse des modifications qui pourraient être apportés aux Lignes directrices et mené des consultations bilatérales avec l’industrie, les gouvernements F-P-T et les consommateurs.
En 2007, une autre problématique est apparue lorsque la Cour fédérale du Canada a rendu sa décision suite à une requête de révision judiciaire. Selon cette décision, les brevetés sont tenus, en vertu du Règlement, d’inclure tous les avantages qu’ils consentent à leurs clients dans le calcul du prix moyen de leur médicament breveté. De l’avis des brevetés, cette décision ne les encourage pas à consentir des avantages à leurs clients et est même susceptible de les amener à mettre un terme aux avantages qu’ils leur offrent actuellement du fait que leur inclusion dans le calcul du prix moyen se traduit par une baisse de ce prix.
Le CEPMB poursuit son analyse des questions associées à l’initiative générale d’examen des Lignes directrices. Le CEPMB étant légalement tenu de respecter le Règlement et les décisions de la Cour fédérale, il examine la possibilité de modifier son Règlement et ses Lignes directrices. Il doit s’assurer que les modifications susceptibles d’être apportées sont conformes à la responsabilité dont l’investit la Loi et qui est de veiller à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs, sans toutefois faire indûment obstacle aux avantages que les brevetés consentent à leurs clients.
Le CEPMB a poursuivi le travail d’élaboration des modifications au Règlement sur les médicaments brevetés, 1994 (Règlement) qui spécifient les données dont les brevetés doivent faire rapport au Conseil ainsi que les délais dans lesquels ils doivent le faire. Les modifications proposées ont été publiées dans la Partie I de la Gazette du Canada du 31 décembre 2005, mais des révisions y ont été apportées à la lumière des commentaires reçus des intervenants. Une consultation plus vaste est devenue nécessaire et une version révisée des modifications proposées au Règlement a été publiée dans la Partie I de la Gazette du Canada du 6 octobre 2007. La version finale des modifications proposées devrait être publiée dans la partie II de la Gazette du Canada au début du nouvel exercice financier après quoi le règlement modifié sera enregistré et entrera en vigueur le jour de son enregistrement, à moins qu’une date d’entrée en vigueur ultérieure visant certaines dispositions ait été prévue. Lorsque le nouveau règlement sera officiellement en vigueur, le personnel du Conseil communiquera aux brevetés tous les changements apportés aux exigences en matière de rapport et révisera ses formulaires pour en assurer la conformité au règlement modifié. Il mènera également une campagne d’information auprès de ses intervenants.
Pour l’exercice financier 2007-2008, le CEPMB a reçu des ressources financières additionnelles au titre du Budget principal des dépenses pour ses audiences publiques et pour la révision de ses Lignes directrices. Comme on peut le voir dans les tableaux présentés dans le présent document aux pages 8 et 10, ce financement temporaire ne sera plus disponible à l’échéance de l’exercice 2007-2008. Le CEPMB tente actuellement d’obtenir une majoration de son financement permanent pour tenir compte de l’alourdissement de sa charge de travail et des besoins opérationnels qui en découlent.
Priorité 2 : Tendances de l’industrie pharmaceutique
Chaque année, en application des articles 89 et 100 de la Loi sur les brevets, le CEPMB fait rapport de ses activités au Parlement par le truchement du ministre de la Santé. Ce rapport, qui porte sur une année civile, passe en revue les principales activités du Conseil, analyse les tendances des prix des médicaments brevetés et autres et fait état des dépenses de R-D déclarées par les brevetés. Le CEPMB rend également compte de ses activités et des tendances des prix des médicaments au moyen de son feuillet trimestriel La Nouvelle et de différents rapports d’études.
De plus, en vertu d’une entente intervenue entre les ministres F-P-T de la Santé et à la demande expresse que lui a faite le ministre fédéral de la Santé en vertu de l’article 90 de la Loi sur les brevets, le CEPMB effectue des recherches au titre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). L’objet de cette participation du CEPMB en partenariat avec l’Institut canadien d’information sur la santé (ICIS) est de fournir des analyses critiques des tendances des prix, de l’utilisation faite des médicaments et des leurs coûts pour que le régime de santé canadien ait accès à des renseignements exacts et complets sur l’utilisation des médicaments d’ordonnance et sur les facteurs d’augmentation des coûts en médicaments.
En octobre 2005, le ministre fédéral de la Santé, agissant en son nom personnel et au nom de ses homologues des provinces et des territoires, a demandé au CEPMB d’assurer le suivi des prix des médicaments non brevetés distribués sous ordonnance au Canada et de présenter ses observations sous forme de rapports et ce, dans le contexte de la Stratégie nationale sur les produits pharmaceutiques. Toutefois, à partir de l’exercice financier 2008-2009, cette activité de suivi et de rapport s’inscrira sous le SNIUMP.
En vertu d’un protocole d’accord, ces différentes initiatives menées à la demande du ministre sont financées au moyen de réaffectations du budget de Santé Canada.
SECTION II – ANALYSE DES ACTIVITÉS DU PROGRAMME SELON LE RÉSULTAT STRATÉGIQUE
Analyse détaillée des activités du programme
Le programme du CEPMB compte un seul objectif stratégique, mais deux activités.
Résultat stratégique
Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également informée des tendances de l’industrie pharmaceutique .
Activités du programme :
1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés.
2 : Tendances de l’industrie pharmaceutique .
1ère activité du programme : Conformité et pratique de prix non excessifs pour les médicaments brevetés
| 2008-2009 | 2009-2010 | 2010-2011 |
| 3 194,0 | 3 194,0 | 3 194,0 |
| 2008-2009 | 2009-2010 | 2010-2011 |
| 25,5 | 25,5 | 25,5 |
Le CEPMB est chargé de s’assurer que les prix « départ-usine », à savoir les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés aux grossistes, aux hôpitaux et aux pharmacies et à d’autres clients, ne sont pas excessifs. Ces médicaments sont pour un usage humain ou pour un usage vétérinaire et sont distribués sous ordonnance ou en vente libre.
Le CEPMB compte dans toute la mesure du possible sur la conformité volontaire des brevetés, une formule qui se révèle plus efficace, plus rapide et plus économique pour toutes les parties. Cette conformité est facilitée par les Lignes directrices dont la raison d’être est d’aider les brevetés à pratiquer des prix qui ne sont pas excessifs en leur communiquant des renseignements clairs sur la façon dont est effectué l’examen des prix des médicaments. Ces lignes directrices sont publiées dans le Compendium des Lignes directrices, politiques et procédures ( Compendium), lequel est affiché dans notre site Web (www.pmprb-cepmb.gc.ca) sous la rubrique « Loi, Règlement et Lignes directrices ».
Le CEPMB passe en revue les données sur les prix de lancement et puis les prix courants des médicaments dont les brevetés lui font rapport dans des rapports semestriels qu’ils soumettent au Conseil en vertu du Règlement sur les médicaments brevetés, 1994 . Le CEPMB s’assure ainsi que les prix de tous les médicaments brevetés vendus au Canada ne sont pas excessifs.
Les Lignes directrices établissent la façon d’appliquer les facteurs de fixation du prix des médicaments brevetés mentionnés dans l’article 85 de la Loi sur les brevets. Elles ont été élaborées et modifiées en consultation avec les intervenants, dont l’industrie pharmaceutique, les ministres F-P-T de la Santé, les associations de consommateurs et (en vertu du paragraphe 96(5) de la Loi sur les brevets) ainsi qu’avec d’autres intervenants choisis par le Conseil.
L’article 85 de la Loi sur les brevets se lit comme suit :
85. (1) Pour décider si le prix d’un médicament vendu sur un marché canadien est excessif, le Conseil tient compte des facteurs suivants, dans la mesure où des renseignements sur ces facteurs lui sont disponibles :
- le prix de vente du médicament sur un tel marché;
- le prix de vente de médicaments de la même catégorie thérapeutique sur un tel marché;
- le prix de vente du médicament et d’autres médicaments de la même catégorie thérapeutique à l’étranger;
- les variations de l’indice des prix à la consommation (IPC); et
- tous les autres facteurs précisés par les règlements d’application du présent paragraphe.
85. (2) Si, après avoir tenu compte de ces facteurs, il est incapable de décider si le prix d’un médicament vendu sur un marché canadien est excessif, le Conseil peut tenir compte des facteurs suivants :
- les coûts de réalisation et de mise en marché;
- tous les autres facteurs précisés par les règlements d’application du présent paragraphe ou qu’il estime pertinents.
85. (3) Pour l’application de l’article 83, le Conseil ne tient compte, dans les coûts de recherche, que de la part canadienne des coûts mondiaux directement liée à la recherche qui a abouti soit à l’invention du médicament, soit à sa mise au point et à sa mise en marché, calculée proportionnellement au rapport entre les ventes canadiennes du médicament par le breveté et le total des ventes mondiales.
Les Lignes directrices expliquent comment évaluer ces facteurs. Elles déterminent dans laquelle des trois catégories le nouveau médicament doit être classé ainsi que les tests qui doivent être appliqués aux prix selon la catégorie dans laquelle le médicament a été classé.
Le résultat attendu de cette activité du programme est que, au Canada, les médicaments brevetés ne sont pas vendus à des prix excessifs considérant les facteurs mentionnés dans la Loi sur les brevets.
L’indicateur qui permet de vérifier si le CEPMB a réussi à atteindre le résultat attendu et, partant, son objectif stratégique, est le pourcentage des médicaments brevetés jugés conformes aux Lignes directrices sur les prix excessifs.
Cette activité souscrit à la priorité du gouvernement en matière d’affaires sociales qui est de favoriser la santé de la population canadienne en lui assurant un accès aux médicaments brevetés à des prix non excessifs.
2e activité du programme : Tendances de l’industrie pharmaceutique
| 2008-2009 | 2009-2010 | 2010-2011 |
| 2 648,0 | 2 648,0 | 2 648,0 |
| 2008-2009 | 2009-2010 | 2010-2011 |
| 20,5 | 20,5 | 20,5 |
Le CEPMB est également chargé de bien renseigner la population canadienne sur les tendances de l’industrie pharmaceutique . À cette fin, le CEPMB fait annuellement rapport de ses principales activités, des résultats de ses analyses des prix des produits pharmaceutiques et des tendances observées ainsi que des dépenses de recherche-développement déclarées par les brevetés.
Le Règlement oblige les brevetés à faire rapport au CEPMB de la valeur totale de leurs ventes au Canada de leurs médicaments brevetés et non brevetés. Les brevetés sont également tenus de soumettre au CEPMB des données détaillées sur les prix de leurs médicaments brevetés ou sur les recettes qu’ils tirent des ventes de médicaments brevetés ainsi que sur les volumes de leurs ventes, ventilées selon la catégorie de clients6 dans chaque province ou territoire. Le CEPMB utilise ces renseignements pour ses analyses des tendances des ventes de médicaments brevetés, de leur utilisation et de leurs prix. Le CEPMB présente les résultats de ses analyses dans son rapport annuel.
Le CEPMB compile l’Indice des prix des médicaments brevetés (IPMB). Cet indice permet au CEPMB d’observer les tendances des prix au Canada des médicaments brevetés à partir du prix de transaction moyen pour l’ensemble du pays. Cet indice est actualisé chaque année à l’aide des données sur les prix et sur les ventes fournies par les brevetés.
La Loi sur les brevets et le Règlement exigent des brevetés qu’ils fassent rapport au CEPMB des prix publics départ-usine des médicaments brevetés pratiqués dans les sept pays de comparaison nommés dans le Règlement, à savoir la France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis. Ces prix sont utilisés pour 1) les comparaisons des prix pratiqués dans les différents pays prévues dans les Lignes directrices et 2) les comparaisons des prix des médicaments brevetés pratiqués au Canada avec les prix pratiqués dans les autres pays. Le CEPMB utilise également ces éléments d’information pour établir les variations de prix par pays.
Comme le prévoit la Loi sur les brevets, le CEPMB fait un suivi des dépenses de R-D des brevetés au Canada et en fait rapport, mais il n’a toutefois aucun doit de regard sur le type de R-D effectuée ni sur la valeur des dépenses des brevetés dans la R-D.
En vertu de l’article 90 de la Loi sur les brevets, le Ministre a demandé au CEPMB de jouer un rôle au niveau du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Le mandat du SNIUMP est de préparer des analyses critiques des tendances des prix des médicaments distribués sous ordonnance de manière à fournir au régime de soins de santé canadien des renseignements complets et précis sur l’utilisation faite des médicaments et sur les facteurs d’augmentation des coûts. Le CEPMB et l’Institut canadien d’information sur la santé (ICIS) sont partenaires au titre du SNIUMP. Un comité directeur formé de représentants de Santé Canada et des différents régimes F-P-T d’assurance-médicaments (exclusion faite de celui du Québec) conseille le CEPMB sur le développement du SNIUMP et propose des sujets d’analyse.
Au cours de l’exercice 2008-2009, le CEPMB produira un premier Rapport sommaire sur les tendances des prix des médicaments. Par la suite, ce rapport sera publié à tous les deux ans. On trouvera dans ce rapport de l’information sur les tendances des prix des médicaments et des dépenses en médicaments, sur les niveaux de prix et sur les facteurs d’augmentation des coûts en médicaments avec lesquels doivent composer les régimes provinciaux/territoriaux d’assurance-médicaments.
Par ailleurs, le CEPMB axera ses efforts sur des études concernant l’élaboration de méthodologies pouvant répondre aux préoccupations exprimées par les régimes publics d’assurance-médicaments ainsi que sur certaines études s’intéressant aux priorités des régimes publics d’assurance-médicaments.
En 2007-2008, le CEPMB a publié l’Observateur des médicaments émergents. Ce rapport sera publié annuellement. Il présente un sommaire de l’information disponible sur les nouveaux médicaments ayant atteint les dernières phases de la recherche et qui sont susceptibles d’avoir une incidence importante au niveau de la valeur thérapeutique. D’autres études sont prévues, dont une sur la méthodologie de prévision des dépenses (en cours) et une participation à une étude sur les coûts associés à l’assurance des médicaments onéreux menée au titre de la Stratégie nationale sur les produits pharmaceutiques.
Enfin, le CEPMB fait aussi rapport des prix des médicaments non brevetés distribués sous ordonnance. À l’automne 2005, les ministres F-P-T de la Santé ont convenu de confier au CEPMB la tâche de faire un suivi des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Cette initiative s’inscrit sous la priorité F-P-T et sous la Stratégie nationale sur les produits pharmaceutiques qui est d’atteindre la parité internationale des prix des médicaments non brevetés distribués sous ordonnance.
Ces deux dernières initiatives (SNIUMP et Prix des médicaments non brevetés distribués sous ordonnance) ont été financées au moyen d’une réaffectation du budget de Santé Canada.
En vertu d’un nouveau protocole d’accord intervenu avec Santé Canada pour l’exercice 2008-2009 et suivant, les études menées au titre du SNIUMP et de l’initiative Prix des médicaments non brevetés distribués sous ordonnance relèveront désormais du SNIUMP. Cette mesure a été rendue nécessaire parce que le financement accordé au SNIUMP a été réduit et que Santé Canada a cessé de prendre à sa charge les coûts d’achat des données d’IMS Health qui sont utilisées pour les rapports. Ainsi, en vertu d’une entente de partage des données intervenue entre le CEPMB et l’ICIS, le CEPMB utilisera essentiellement pour ses études au titre du SNIUMP l’information sur les médicaments distribués sous ordonnance fournies par les régimes F-P-T d’assurance-médicaments participants et, lorsque les ressources le lui permettront, pour les analyses des prix des médicaments des provinces et des tendances des prix des médicaments non brevetés distribués sous ordonnance.
Le résultat attendu de cette activité est que les intervenants seront mieux renseignés sur les tendances de l’industrie pharmaceutique ainsi que sur les facteurs à l’origine de l’augmentation des coûts en médicaments. Ces éléments d’information contribuent à éclairer les processus de prise de décisions et d’élaboration de politiques.
Les indicateurs qui révèlent la mesure dans laquelle le CEPMB atteint le résultat attendu sont : 1) le nombre de demandes de publications du CEPMB reçues; et 2) le nombre d’activités auxquelles le CEPMB participe.
Cette activité souscrit à l’objectif du gouvernement du Canada en matière d’affaires sociales qui est de favoriser la santé de la population canadienne en la renseignant sur les tendances des prix des produits pharmaceutiques et des facteurs à l’origine de l’augmentation des coûts en médicaments.
SECTION III – RENSEIGNEMENTS SUPPLÉMENTAIRES
Tableau 1 : Liens du ministère avec les résultats du gouvernement du Canada
| Résultat stratégique : Les médicaments brevetés ne peuvent être vendus au Canada à des prix excessifs, afin de protéger les intérêts de la population canadienne et leur régime de soins de santé. La population canadienne est également informée des tendances de l’industrie pharmaceutique. | |||||
| Activité du programme | Résultats escomptés |
Dépenses prévues (en milliers de dollars) |
Harmonisation avec le secteur de résultats du gouvernement du Canada | ||
| 2008-2009 | 2009-2010 | 2010-2011 | |||
| Conformité et pratique de prix non excessifs pour les médicaments brevetés | Les prix au Canada des médicaments brevetés ne sont pas excessifs conformément aux facteurs spécifiés dans la Loi sur les brevets. | 3 194,0 | 3 194,0 | 3 194,0 | Population canadienne en santé |
| Tendances de l’industrie pharmaceutique | Les intervenants sont mieux renseignés sur les tendances de l’industrie pharmaceutique et sur les facteurs d’augmentation des coûts en médicaments | 2 648,0 | 2 648,0 | 2 648,0 | Population canadienne en santé |
Tableaux disponibles sous forme électronique à l’adresse : http://www.tbs-sct.gc.ca/rpp/2008-2009/info/info-fra.asp
Tableau 2: Services reçus à titre gracieux
Tableau 3: Sources de revenus non disponibles
1 Les recettes non disponibles ne représentent pas des recettes réalisées par le CEPMB. Elles correspondent plutôt aux sommes que les brevetés versent au gouvernement du Canada aux termes d’un engagement de conformité volontaire ou d’une ordonnance de remboursement des recettes excessives rendue par le Conseil. Le ministre est habilité à conclure des ententes avec toute province ou tout territoire concernant la remise des sommes ainsi perçues par le Receveur général, moins les coûts engagés pour leur perception et pour leur distribution.
2 Les services reçus à titre gracieux sont affectés aux postes de dépense suivants : locaux fournis par Travaux publics et services gouvernementaux Canada, contributions de l’employeur aux primes du régime d’assurance des employés, dépenses assumées par le Secrétariat de Conseil du Trésor du Canada, traitements et dépenses connexes liés aux services juridiques offerts par Justice Canada.
3 Le CEPMB n’a pas droit de regard sur les prix des médicaments non brevetés. Il n’a pas non plus compétence sur les prix auxquels les grossistes et les détaillants vendent les médicaments ni sur les honoraires des pharmaciens. De même, des questions comme l’admissibilité des médicaments à un remboursement par les régimes publics d’assurance-médicaments, la distribution des médicaments et les méthodes d’ordonnance des médecins ne relèvent pas de la compétence du CEPMB.
4 Vous trouverez de plus amples renseignements sur ces lignes directrices dans le chapitre 1 du Compendium des Lignes directrices, politiques et procédures disponible sur notre site Web (www.pmprb-cepmb.gc.ca), sous la rubrique « Loi, Règlement, Lignes directrices ».
5 Vous trouverez à l’appendice 5 du Compendium des Lignes directrices, politiques et procédures de plus amples renseignements sur les critères justifiant la tenue d’une enquête sur le prix d’un médicament. Le Compendium est affiché sur notre site Web (www.pmprb-cepmb.gc.ca) sous la rubrique « Loi, Règlement, Lignes directrices ».
6 Les catégories de clients sont les pharmacies, les hôpitaux, les grossistes et autres.
Tableau 2: Services reçus à titre gracieux
| (en milliers de dollars) |
2008-2009 |
| Locaux fournis par Travaux publics et Services gouvernementaux Canada (TPSGC) |
536.8 |
| Contributions de l’employeur aux primes du régime d’assurance des employés et dépenses payées par le Secrétariat du Conseil du Trésor du Canada (sauf les fonds renouvelables) |
288.6 |
| Traitements et dépenses connexes liés aux services juridiques fournis par le ministère de la Justice du Canada |
10.1 |
| Total des services reçus à titre gracieux en 2008-2009 |
835.5 |
Tableau 3: Sources de revenus non disponibles
| (en milliers de dollars) |
Prévisions de revenus |
Revenus prévus |
Revenus prévus |
Revenus prévus |
| Activité de Programme: Conformité et pratique de prix non excessifs pour les médicaments brevetés | ||||
| Engagements de conformité volontaire |
9,478.5 |
- |
- |
- |
| Total des revenus non disponibles |
9,478.5 |
- |
- |
- |
1 Les recettes non disponibles ne représentent pas des recettes réalisées par le CEPMB. Elles sont constituées de sommes que les brevetés versent au gouvernement du Canada aux termes des engagements de conformité volontaire ou des ordonnances de remboursement des recettes excessives rendues par le Conseil. Le ministre est habileté à conclure des ententes avec toute province ou tout territoire concernant la remise des sommes ainsi perçues par le Receveur général, moins les coûts engagés pour leur perception et pour leur distribution.