Liens de la barre de menu commune
Fil d'Ariane
ARCHIVÉ - Conseil d'examen du prix des médicaments brevetés Canada
 Cette page a été archivée.
Cette page a été archivée.
Information archivée dans le Web
Information archivée dans le Web à des fins de consultation, de recherche ou de tenue de documents. Cette dernière n’a aucunement été modifiée ni mise à jour depuis sa date de mise en archive. Les pages archivées dans le Web ne sont pas assujetties aux normes qui s’appliquent aux sites Web du gouvernement du Canada. Conformément à la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange à la page « Contactez-nous ».
SECTION I – SURVOL
Message du président
C’est avec plaisir que je vous présente le Rapport sur les plans et les priorités de 2008-2009 du Conseil d’examen du prix des médicaments brevetés (CEPMB).
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Créé par le Parlement en 1987 en vertu de la Loi sur les brevets, il est investi d’un double mandat, à savoir d’un mandat de réglementation et d’un mandat de rapport. En vertu de son mandat de réglementation, le CEPMB veille à ce que les prix des médicaments brevetés ne soient pas excessifs, protégeant ainsi les intérêts des consommateurs et contribuant au régime de soins de santé canadien. En vertu de son mandat de rapport, le CEPMB fait rapport des tendances des prix des produits pharmaceutiques et des dépenses des brevetés dans la recherche et développement au Canada, éclairant ainsi les processus de prise de décisions et d’élaboration des politiques. Le CEPMB contribue également à l’amélioration de la santé de la population canadienne en exigeant des brevetés qu’ils réduisent les prix de leurs médicaments brevetés lorsque ceux-ci sont jugés excessifs et en atténuant les pressions qu’exercent les coûts en médicaments sur notre régime de soins de santé.
Depuis sa création, le CEPMB a réussi dans une large mesure à exercer son mandat en tenant un nombre relativement restreint d’audiences publiques. Il en a été ainsi non pas parce que le CEPMB n’appliquait pas la Loi avec diligence, mais plutôt en raison de l’efficacité des Lignes directrices du Conseil sur les prix excessifs et de notre Politique de conformité volontaire. En 2005-2006, dans l’exercice de son mandat de réglementation, le CEPMB a pressenti une augmentation marquée du nombre d’enquêtes et d’audiences sur les prix de médicaments brevetés et conclu que le moment était venu de réviser ses Lignes directrices sur les prix excessifs. Pour combler les besoins pressants et atténuer les pressions qui s’exercent, le CEPMB a obtenu des crédits supplémentaires de 5 millions de dollars pour l’exercice 2006-2007 et la même somme pour l’exercice 2007-2008. La mesure dans laquelle le CEPMB réussit à bien exercer son mandat dépend de sa capacité de tenir des audiences lorsque celles-ci se révèlent nécessaires ainsi que de la pertinence et de l’efficacité de ses Lignes directrices. Au cours des dernières années, le nombre d’audiences du Conseil a augmenté tout comme leur complexité. Depuis janvier 2006 seulement, le Conseil a engagé neuf audiences par opposition à huit pour la période de 1987 à 2005.
Nos Lignes directrices existent dans leur forme actuelle depuis 1994. Des initiatives récentes, telle que la Loi de 2006 sur un régime de médicaments transparents pour les patients (Ontario), les modifications à la Loi sur l’assurance-médicaments et modifiant diverses dispositions législatives (Québec, 2005) et la Stratégie nationale sur les produits pharmaceutiques adoptée par les gouvernements fédéral, provinciaux et territoriaux, ont fait braquer les projecteurs sur les prix des médicaments et sur les tendances des coûts en médicaments. Parallèlement, le CEPMB a prêté une oreille attentive aux préoccupations de ses intervenants concernant les prix de lancement élevés des nouveaux médicaments et autres sujets. Afin d’atténuer ces préoccupations, le Conseil a entrepris un processus de révision de ses Lignes directrices et ce, en consultation avec ses intervenants comme l’exige la Loi sur les brevets. À la lumière des réponses obtenues, le Conseil a effectué une analyse en profondeur et tenu des séances de consultation. Il a continué d’évaluer les modifications aux Lignes directrices suggérées et mène en parallèle des consultations bilatérales avec l’industrie, les gouvernements et les consommateurs afin que la révision des Lignes directrices soit complétée à l’automne 2008. Par ailleurs, une décision de la Cour fédérale rendue en mars 2007 nous laisse craindre que, dans leur forme actuelle, le Règlement sur les médicaments brevetés, 1994 (le Règlement) et les Lignes directrices amènent les brevetés à cesser d’offrir différents avantages aux consommateurs. Le CEPMB évalue actuellement les mesures qui pourraient être mises en oeuvre pour régler la situation. Lorsque des décisions auront été prises et mises en œuvre, un suivi sera exercé en permanence et les ajustements requis seront apportés pour s’assurer que les Lignes directrices sont pertinentes et efficaces dans le contexte de l’environnement pharmaceutique actuel et que le processus d’examen du prix demeure transparent et prévisible.
En 2001, le ministre de la Santé a demandé au CEPMB d’effectuer, en collaboration avec l’Institut canadien d’information sur la santé (ICIS) et les régimes F-P-T d’assurance-médicaments participants, des analyses des prix des médicaments et de faire rapport des tendances observées et ce, au titre du Système national d’information sur les médicaments prescrits (SNIUMP). Par ses analyses critiques des tendances des prix des médicaments, de l’utilisation faite des médicaments et des coûts, le CEPMB fournit au régime canadien de soins de santé des renseignements complets, judicieux et utiles sur les tendances des prix des médicaments distribués sous ordonnance et sur les facteurs d’augmentation des coûts en médicaments.
En octobre 2005, dans le cadre de la Stratégie nationale sur les produits pharmaceutiques, le CEPMB a été chargé par le ministre fédéral de la Santé de faire le suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. À compter de l’exercice 2008-2009, ce suivi et ces rapports seront effectués au titre du SNIUMP.
Enfin, le CEPMB continue d’exercer son mandat avec équité et transparence.

Brien G. Benoit, M.D.
Président
Déclaration de la direction
Je soumets, aux fins de son dépôt au Parlement, le Rapport sur les plans et les priorités (RPP) de 2008-2009 du Conseil d’examen du prix des médicaments brevetés.
Le présent document a été préparé conformément aux principes de présentation des rapports énoncés dans le Guide de préparation de la Partie III du Budget des dépenses 2008-2009 : Rapports sur les plans et les priorités et Rapports ministériels sur le rendement.
- Il est conforme aux exigences précises de déclaration figurant dans les lignes directrices du Secrétariat du Conseil du Trésor;
- Il repose sur les résultats stratégiques et l’architecture des activités de programme du ministère qui ont été approuvés par le Conseil du Trésor;
- Il présente une information cohérente, complète, équilibrée et fiable;
- Il fournit une base pour la reddition de comptes à l’égard des résultats obtenus avec les ressources et les autorisations qui lui sont confiées;
- Il rend compte de la situation financière en fonction des chiffres des dépenses prévues approuvés provenant du Secrétariat du Conseil du Trésor du Canada.

Nom : Brien G. Benoit, MD
Titre : Président
Raison d’être
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est investi d’un double mandat :
|
Réglementation – Veiller à ce que les prix auxquels les fabricants vendent leurs médicaments brevetés ne soient pas excessifs, protégeant ainsi les intérêts des consommateurs et contribuant au système de santé canadien. Rapport – Faire rapport sur les tendances de l’industrie pharmaceutique ainsi que sur les dépenses que les brevetés engagent dans la R-D au Canada, éclairant ainsi les processus de prise de décisions et d’élaboration des politiques. |
Organigramme
Portefeuille de la Santé
Le ministre de la Santé est chargé de maintenir et d’améliorer la santé des Canadiens et des Canadiennes. Il reçoit le soutien du portefeuille de la Santé qui comprend Santé Canada, l’Agence de santé publique du Canada, les Instituts de recherche en santé du Canada, le Conseil de contrôle des renseignements relatifs aux matières dangereuses, le Conseil d’examen du prix des médicaments brevetés et Procréation assistée Canada. Chaque membre du portefeuille prépare son propre Rapport sur les plans et priorités. Le portefeuille de la Santé se compose d’environ 12 000 employés équivalant temps plein et dispose d’un budget annuel de plus de 3,8 milliards de dollars.
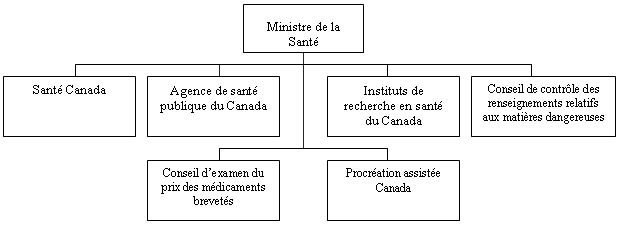
Le Conseil d’examen du prix des médicaments brevetés
Le ministre de la Santé veille à la bonne application des dispositions de la Loi sur les brevets relatives aux médicaments (articles 79 à 103 de la Loi) et, comme l’exige la Loi, fait rapport au Parlement des activités du CEPMB par le truchement du Rapport sur les plans et les priorités, du Rapport sur la performance du ministère et du Rapport annuel du CEPMB. C’est également le ministre de la Santé qui recommande au gouverneur en conseil la nomination des membres du Conseil ainsi que les modifications qu’il y aurait lieu d’apporter aux Règlements sur les médicaments brevetés, 1994. Le ministre peut aussi demander au Conseil de mener des enquêtes en vertu de l’article 90 de la Loi sur les brevets.
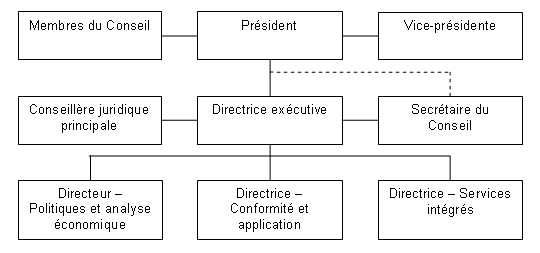
Le Conseil est formé d’au plus cinq membres siégeant à temps partiel, dont un président et un vice-président. Les nominations au Conseil sont faites par le gouverneur en conseil. En juin 2006, le Dr Benoit, alors vice-président du Conseil, a été nommé président du Conseil et Mme Mary Catherine Lindberg a été nommée membre et vice-présidente pour un mandat de cinq ans. En mars 2007, Mme Anne Warner LaForest a été nommée membre du Conseil pour un mandat de cinq ans. M. Anthony Boardman a été reconduit dans ses fonctions pour un deuxième mandat en 2005 et M. Thomas (Tim) Armstrong, en 2007.
Aux termes de la Loi sur les brevets , le président du Conseil est également le premier dirigeant du CEPMB et, à ce titre, supervise et dirige les activités du Conseil. Pour sa part, la directrice exécutive dirige le travail du personnel. Les cadres supérieurs du CEPMB sont la directrice exécutive, la directrice - Conformité et application, le directeur - Politiques et analyse économique, la directrice - Services intégrés, la secrétaire du Conseil et la conseillère juridique principale.
La Direction de la conformité et de l’application est en grande partie responsable de l’examen du prix des médicaments brevetés ainsi que de l’application de la politique de conformité et d’application. La Direction des politiques et de l’analyse économique est responsable de la conduite des analyses de politiques, de la préparation des rapports sur les tendances des prix des médicaments et autres études économiques ainsi que de la prestation de conseils stratégiques. Le Secrétariat du Conseil, la Direction des services intégrés et les Services juridiques s’occupent respectivement des communications, de l’administration et du soutien juridique. De plus, le Secrétariat assure un soutien aux membres du Conseil dans l’exercice de leurs fonctions et gère le processus d’audience.
Concordance de l’architecture des activités du programme (AAP)
|
2008-2009 |
|||
|
Nouvelles activités du programme |
|||
|
(en milliers de dollars) |
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
Tendances de l’industrie pharmaceutique |
Total |
|
Examen du prix des médicaments brevetés |
3 194,0 |
2 648,0 |
5 842,0 |
En raison de ce changement, l’architecture des activités du programme compte désormais les deux rôles mentionnés dans la Loi sur les brevets, à savoir « réglementation » et « rapport ».
Crédits votés et crédits législatifs figurant dans le Budget principal des dépenses
|
Crédit voté ou législatif |
Libellé tronqué pour le crédit voté ou législatif |
Budget principal |
Budget principal |
|
35 |
Dépenses du Programme |
5 211,0 |
10 584,0 |
|
(S) |
Contributions aux régimes des avantages sociaux des employés |
631,0 |
891,0 |
|
|
Total pour le CEPMB |
5 842,0 |
11 475,0 |
Le Budget principal des dépenses pour 2008-2009 a été révisé à la baisse pour les raisons suivantes : 1) échéance du financement additionnel de 5 millions consentis en 2007-2008 dans le Budget principal des dépenses aux fins de la tenue d’audiences publiques et de la révision des Lignes directrices sur les prix excessifs; 2) nouveau protocole d’accord intervenu entre le CEPMB et Santé Canada aux fins du financement des activités du CEPMB au titre du Système national d’information sur les médicaments brevetés (SNIUMP), le financement passant ainsi de 1,350 million de dollars qu’il était à 850 millions de dollars (le financement de 560 000 $ pour les rapports sur les prix des médicaments non brevetés distribués sous ordonnance est maintenu, mais il s’inscrit désormais sous le poste du SNIUMP); et 3) réduction de 200 000 $ du financement consenti par Santé Canada pour l’initiative sur l’amélioration du processus d’examen des prix du CEPMB s’inscrivant dans la Stratégie d’accès aux produits thérapeutiques (SAPT).
Dépenses prévues et équivalents temps plein
|
(en milliers de dollars) |
Prévisions des dépenses |
Dépenses prévues |
Dépenses prévues |
Dépenses prévues |
|
Examen du prix des médicaments brevetés |
11 475,0 |
- |
- |
- |
|
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
- |
3 194,0 |
3 194,0 |
3 194,0 |
|
Tendances de l’industrie pharmaceutique |
- |
2 648,0 |
2 648,0 |
2 648,0 |
|
Estimé principal des dépenses (montant brut) |
11 475,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Moins : Revenus disponibles |
- |
- |
- |
- |
|
Total des dépenses prévues |
11 475,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Rajustements : |
|
|
|
|
|
Économies au niveau des approvisionnements |
|
|
|
|
|
Conformité et pratique de prix non excessifs pour les médicaments brevetés |
- |
- |
- |
- |
|
Tendances de l’industrie pharmaceutique |
- |
- |
- |
- |
|
Autres |
|
|
|
|
|
Crédit 15 du Conseil du Trésor |
42,0 |
|
|
|
|
Régime d’avantages sociaux des employés (RASE) |
8,0 |
|
|
|
|
Total des rajustements |
50,0 |
|
|
|
|
Total des dépenses prévues |
11 525,0 |
5 842,0 |
5 842,0 |
5 842,0 |
|
Moins : Revenus non disponibles1 |
(9 478,5) |
- |
- |
- |
|
Plus : Valeur des services reçus à titre gracieux 2 |
981,4 |
835,5 |
824,0 |
824,4 |
|
Total des dépenses du CEPMB |
3 027,9 |
6 677,5 |
6 666,0 |
6 666,4 |
|
Équivalents temps plein |
62,0 |
46,0 |
46,0 |
46,0 |
Renseignements sommaires
|
20082009 |
2009-2010 |
2010-2011 |
|
5 842,0 |
5 842,0 |
5 842,0 |
|
2008-2009 |
2009-2010 |
2010-2011 |
|
46,0 |
46,0 |
46,0 |
Priorités du CEPMB
|
Nom |
Type |
|
1. Conformité et pratique de prix non excessifs pour les médicaments brevetés |
En cours |
|
2. Tendances de l’industrie pharmaceutique |
En cours |
Activités du programme par résultat stratégique
|
|
|
Dépenses prévues |
|
||
|
|
Résultats escomptés |
2008-2009 |
2009-2010 |
2010-2011 |
Contribue à la priorité suivante |
|
Résultat stratégique : |
Les médicaments brevetés ne sont pas vendus à des prix excessifs au Canada et ce, pour les meilleurs intérêts de la population canadienne et du régime de soins de santé. Les Canadiens sont aussi mieux renseignés sur les tendances de l’industrie pharmaceutique . |
|
|||
|
Activité du programme no 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés |
Les brevetés vendent leurs médicaments brevetés au Canada à des prix jugés non excessifs à la lumière des facteurs mentionnés dans la Loi sur les brevets |
3 194,0 |
3 194,0 |
3 194,0 |
Priorité no 1 |
|
Activité du programme no 2 : Tendances de l’industrie pharmaceutique |
Les intervenants sont mieux renseignés sur les tendances de l’industrie pharmaceutique et sur facteurs d’augmentation des coûts en médicaments |
2 648,0 |
2 648,0 |
2 648,0 |
Priorité no 2 |
Plans et priorités du CEPMB
Priorité 1 : Conformité et pratique de prix non excessifs pour les médicaments brevetés
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 à la suite de la révision de la Loi sur les brevets (projet de loi C-22) qui a accru la protection assurée aux brevets liés à des produits pharmaceutiques. Le CEPMB constitue la composante stratégique de la politique des brevets du gouvernement fédéral dont l’objet est de protéger les intérêts des consommateurs et de contenir les coûts des soins de santé en contrepartie de nouvelles mesures visant à protéger la propriété intellectuelle.
Le CEPMB exerce un contrôle sur les prix « départ-usine » , à savoir sur les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés aux grossistes, aux hôpitaux, aux pharmacies ou à d’autres clients, afin qu’ils ne soient pas excessifs. Ces médicaments sont pour un usage humain ou pour usage vétérinaire et sont distribués sous ordonnance ou en vente libre.3
Le personnel du Conseil fait l’examen des prix de tous les médicaments brevetés vendus au Canada pour en vérifier la conformité aux Lignes directrices sur les prix excessifs (Lignes directrices).4 S’il arrive à la conclusion que le prix d’un médicament breveté semble non conforme aux Lignes directrices et que les critères justifiant la tenue d’une enquête sont réunis, le personnel du Conseil ouvre une enquête pour déterminer si le prix du médicament est effectivement supérieur au prix autorisé en vertu des Lignes directrices.5 Les résultats de l’enquête peuvent être les suivants :
- fin de l’enquête lorsqu’il est établi que le prix est conforme aux Lignes directrices; ou
- engagement de conformité volontaire en vertu duquel le breveté s’engage à réduire le prix de son médicament et à rembourser la partie excessive des recettes qu’il a tirées de la vente de son médicament à un prix excessif; ou
- recommandation faite au président du Conseil qu’il est dans l’intérêt du public de tenir une audience publique pour déterminer si le prix du médicament est ou non excessif et, le cas échéant, de décider de l’ordonnance corrective qu’il y a lieu de rendre.
La mesure dans laquelle le CEPMB exerce bien son mandat dépend de sa capacité de tenir les audiences nécessaires et de s’assurer que ses Lignes directrices demeurent pertinentes et efficaces. Les audiences du Conseil sont devenues au cours des dernières années plus complexes, mais aussi plus nombreuses. À preuve, le Conseil a engagé 9 audiences depuis janvier 2006 alors qu’il n’en avait engagées que 8 entre 1987 et 2005. Au cours des prochaines années, des pressions devraient continuer de s’exercer sur la capacité du CEPMB de bien exercer le mandat qui lui est conféré par la Loi.
En 2005, en application de la Loi sur les brevets, le CEPMB a engagé un dialogue avec ses intervenants (industrie, gouvernements F-P-T, consommateurs et autres) à l’aide de son document de discussion qui portait l’intitulé « Document de discussion : Augmentations des prix des médicaments brevetés ». En mai 2006, le CEPMB a répété l’expérience en publiant le « Guide de discussion aux fins de consultation sur les Lignes directrices du Conseil sur les prix excessifs », lequel s’intéressait plus particulièrement au prix de lancement des nouveaux médicaments. Le CEPMB a analysé les réponses reçues et, à l’automne 2006, a convié ses intervenants à des séances de consultation. En 2007, il a poursuivi son analyse des modifications qui pourraient être apportés aux Lignes directrices et mené des consultations bilatérales avec l’industrie, les gouvernements F-P-T et les consommateurs.
En 2007, une autre problématique est apparue lorsque la Cour fédérale du Canada a rendu sa décision suite à une requête de révision judiciaire. Selon cette décision, les brevetés sont tenus, en vertu du Règlement, d’inclure tous les avantages qu’ils consentent à leurs clients dans le calcul du prix moyen de leur médicament breveté. De l’avis des brevetés, cette décision ne les encourage pas à consentir des avantages à leurs clients et est même susceptible de les amener à mettre un terme aux avantages qu’ils leur offrent actuellement du fait que leur inclusion dans le calcul du prix moyen se traduit par une baisse de ce prix.
Le CEPMB poursuit son analyse des questions associées à l’initiative générale d’examen des Lignes directrices. Le CEPMB étant légalement tenu de respecter le Règlement et les décisions de la Cour fédérale, il examine la possibilité de modifier son Règlement et ses Lignes directrices. Il doit s’assurer que les modifications susceptibles d’être apportées sont conformes à la responsabilité dont l’investit la Loi et qui est de veiller à ce que les médicaments brevetés ne soient pas vendus au Canada à des prix excessifs, sans toutefois faire indûment obstacle aux avantages que les brevetés consentent à leurs clients.
Le CEPMB a poursuivi le travail d’élaboration des modifications au Règlement sur les médicaments brevetés, 1994 (Règlement) qui spécifient les données dont les brevetés doivent faire rapport au Conseil ainsi que les délais dans lesquels ils doivent le faire. Les modifications proposées ont été publiées dans la Partie I de la Gazette du Canada du 31 décembre 2005, mais des révisions y ont été apportées à la lumière des commentaires reçus des intervenants. Une consultation plus vaste est devenue nécessaire et une version révisée des modifications proposées au Règlement a été publiée dans la Partie I de la Gazette du Canada du 6 octobre 2007. La version finale des modifications proposées devrait être publiée dans la partie II de la Gazette du Canada au début du nouvel exercice financier après quoi le règlement modifié sera enregistré et entrera en vigueur le jour de son enregistrement, à moins qu’une date d’entrée en vigueur ultérieure visant certaines dispositions ait été prévue. Lorsque le nouveau règlement sera officiellement en vigueur, le personnel du Conseil communiquera aux brevetés tous les changements apportés aux exigences en matière de rapport et révisera ses formulaires pour en assurer la conformité au règlement modifié. Il mènera également une campagne d’information auprès de ses intervenants.
Pour l’exercice financier 2007-2008, le CEPMB a reçu des ressources financières additionnelles au titre du Budget principal des dépenses pour ses audiences publiques et pour la révision de ses Lignes directrices. Comme on peut le voir dans les tableaux présentés dans le présent document aux pages 8 et 10, ce financement temporaire ne sera plus disponible à l’échéance de l’exercice 2007-2008. Le CEPMB tente actuellement d’obtenir une majoration de son financement permanent pour tenir compte de l’alourdissement de sa charge de travail et des besoins opérationnels qui en découlent.
Priorité 2 : Tendances de l’industrie pharmaceutique
Chaque année, en application des articles 89 et 100 de la Loi sur les brevets, le CEPMB fait rapport de ses activités au Parlement par le truchement du ministre de la Santé. Ce rapport, qui porte sur une année civile, passe en revue les principales activités du Conseil, analyse les tendances des prix des médicaments brevetés et autres et fait état des dépenses de R-D déclarées par les brevetés. Le CEPMB rend également compte de ses activités et des tendances des prix des médicaments au moyen de son feuillet trimestriel La Nouvelle et de différents rapports d’études.
De plus, en vertu d’une entente intervenue entre les ministres F-P-T de la Santé et à la demande expresse que lui a faite le ministre fédéral de la Santé en vertu de l’article 90 de la Loi sur les brevets, le CEPMB effectue des recherches au titre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). L’objet de cette participation du CEPMB en partenariat avec l’Institut canadien d’information sur la santé (ICIS) est de fournir des analyses critiques des tendances des prix, de l’utilisation faite des médicaments et des leurs coûts pour que le régime de santé canadien ait accès à des renseignements exacts et complets sur l’utilisation des médicaments d’ordonnance et sur les facteurs d’augmentation des coûts en médicaments.
En octobre 2005, le ministre fédéral de la Santé, agissant en son nom personnel et au nom de ses homologues des provinces et des territoires, a demandé au CEPMB d’assurer le suivi des prix des médicaments non brevetés distribués sous ordonnance au Canada et de présenter ses observations sous forme de rapports et ce, dans le contexte de la Stratégie nationale sur les produits pharmaceutiques. Toutefois, à partir de l’exercice financier 2008-2009, cette activité de suivi et de rapport s’inscrira sous le SNIUMP.
En vertu d’un protocole d’accord, ces différentes initiatives menées à la demande du ministre sont financées au moyen de réaffectations du budget de Santé Canada.
