ARCHIVĂ - Conseil d'examen du prix des mĂŠdicaments brevetĂŠs Canada
 Cette page a ĂŠtĂŠ archivĂŠe.
Cette page a ĂŠtĂŠ archivĂŠe.
Information archivĂŠe dans le Web
Information archivĂŠe dans le Web Ă Â des fins de consultation, de recherche ou de tenue de documents. Cette dernière nâa aucunement ĂŠtĂŠ modifiĂŠe ni mise Ă Â jour depuis sa date de mise en archive. Les pages archivĂŠes dans le Web ne sont pas assujetties aux normes qui sâappliquent aux sites Web du gouvernement du Canada. ConformĂŠment Ă Â la Politique de communication du gouvernement du Canada, vous pouvez demander de recevoir cette information dans tout autre format de rechange Ă Â la page ÂŤ Contactez-nous Âť.
2006-2007
Rapport sur le rendement
Conseil dexamen du prix des médicaments brevetés
L'honorable Tony Clement
Ministre de la Santé et ministre de lInitiative fédérale du développement économique dans le Nord de lOntario
Table des matičres
- Mandat et compétence
- Enjeux, tendances et défis
- Rendement : Faits saillants
- Tendances des ventes, des prix et des dépenses dans la R-D
SECTION II - ANALYSE DES ACTIVITÉS DU PROGRAMME PAR RÉSULTAT STRATÉGIQUE
Analyse des activités de programme
Priorité 1 : Conformité et application
- Examen des prix
- Examen des prix des médicaments brevetés nouveaux pour usage humain, 2006
- Examen des prix des médicaments brevetés pour usage humain
- Médicaments brevetés dont l'examen du prix était pris en compte dans le Rapport sur le rendement de 2005-2006 : Mise ŕ jour des résultats
- Médicaments brevetés pour usage vétérinaire
- Mesures d'application
- Engagements de conformité volontaire
- Activités quasi-judiciaires - Audiences
- Consultations
Priorité 2 : Rapport sur les tendances des prix des produits pharmaceutiques
- Tendances des prix
- Comparaisons de l'IPMB et de l'IPC
- Variation des prix selon le groupe thérapeutique principal
- Variation des prix selon la catégorie de clients
- Variation des prix selon la province/le territoire
- Variation des prix selon le pays
- Comparaison des prix pratiqués dans les pays de comparaison avec ceux pratiqués au Canada
- Comparaisons multilatérales des prix
- Utilisation des médicaments brevetés
- Ventes de médicaments au Canada par rapport aux ventes dans d'autres pays
- Analyse des dépenses de recherche-développement
- Recettes tirées des ventes
- Dépenses de R-D
- Ratios des dépenses de R-D par rapport aux recettes tirées des ventes
- Le contexte mondial
- Analyses des tendances des prix des médicaments
SECTION III - RENSEIGNEMENTS SUPPLÉMENTAIRES
Tableau financier 1 : Comparaison des dépenses prévues et des dépenses réelles (incluant les ÉTP)
Tableau financier 2 : Ressources par activité de programme
Tableau financier 3 : Postes votés et législatifs
Tableau financier 4 : Services reçus ŕ titre gracieux
Tableau financier 5 : Sources des revenus non disponibles
Tableau financier 6 : États financiers du Conseil d'examen du prix des médicaments brevetés
SECTION I - APERÇU
Message du Président
J'ai l'immense honneur de vous soumettre le Rapport sur le rendement du Conseil d'examen du prix des médicaments brevetés (CEPMB) pour l'exercice 2006-2007.
Le mandat du CEPMB comporte les deux volets suivants :
-
exercer un contrôle sur les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés pour que ces prix ne soient pas excessifs et, ainsi, protéger les intéręts des consommateurs et contribuer au régime de santé canadien
-
faire rapport des tendances des prix des médicaments ainsi que des dépenses de recherche et développement (R-D) au Canada des titulaires de brevets pharmaceutiques afin d'éclairer les processus de prise de décisions et d'élaboration des politiques.
Au cours de la derničre année, le CEPMB s'est beaucoup investi dans l'exercice de son mandat. Au titre du volet réglementation de son mandat, le Conseil a examiné les prix de plus de 1 100 médicaments brevetés, dont 99 nouveaux médicaments devenus assujettis ŕ la compétence du Conseil en 2006. Dans la foulée de ces examens, le Conseil a émis huit Avis d'audience en vertu de l'article 83 de la Loi sur les brevets (la Loi). Les audiences permettent au Conseil de déterminer si un médicament breveté est ou a été vendu sur un marché canadien ŕ un prix excessif.
Au printemps 2006, le Conseil a publié un guide de discussion sur ses Lignes directrices sur les prix excessifs (Lignes directrices) et, quelques mois plus tard, a tenu des consultations dans le cours desquelles il a entendu les points de vue de ses intervenants sur l'opportunité de réviser ses Lignes directrices. Il a notamment été question dans cet examen du classement des nouveaux médicaments aux fins de l'examen du prix, des tests de prix, de l'interprétation de l'expression Ť sur un marché ť, de la Ť révision du prix de référence ť (ŕ savoir s'il est opportun de faire un nouveau calcul du prix de référence), des principes directeurs du processus d'examen du prix. Suite ŕ ces consultations, le Conseil a élargi la portée de la révision de ses Lignes directrices pour y inclure d'autres facteurs de prix mentionnés dans la Loi (comme, par exemple, les prix auxquels les médicaments de comparaison sont vendus dans les pays de comparaison, les coűts de fabrication et de commercialisation) ainsi que l'approche actuellement suivie par le Conseil au niveau de l'application du facteur de rajustement pour tenir compte de l'IPC.
Par ailleurs, le CEPMB a effectué au cours de la période sous examen différentes études et analyses. Il a entre autres publié deux études au titre du Systčme national d'information sur les médicaments prescrits (SNIUMP), ŕ savoir les Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance-médicaments et L'Observateur des médicaments émergents. De plus, aux titres de la Stratégie nationale pour les produits pharmaceutiques et de sa nouvelle responsabilité de suivi des prix des médicaments non brevetés distribués sous ordonnance et de rapport des tendances observées, le Conseil a publié deux autres rapports - Tendances des prix pratiqués au Canada et dans les pays de comparaison, Tendances de la valeur des ventes au Canada et structure du marché et Marché des médicaments dont le brevet est récemment arrivé ŕ échéance.
Au moyen de son site Web, de son feuillet d'information trimestriel La Nouvelle, d'autres avis et publications, le Conseil assure la transparence de ses activités et tient ses intervenants bien informés.
Enfin, le Conseil demeure attentif ŕ son mandat qui est de servir la population canadienne en appliquant un régime de réglementation des prix des médicaments brevetés approprié, efficient et moderne et en la tenant bien informée des tendances récentes des prix des médicaments au Canada.

Brien G. Benoit, MD
Président
Déclaration de la direction
Je soumets, aux fins de dépôt au Parlement, le Rapport ministériel sur le rendement de 2006-2007 du Conseil d'examen du prix des médicaments brevetés.
Le présent document a été préparé conformément aux principes de présentation des rapports énoncés dans le Guide de préparation de la Partie III du Budget des dépenses 2006-2007 : Rapports sur les plans et les prioritiés et Rapports ministériels sur le rendement :
-
Il est conforme aux exigences précises de déclaration figurant dans les lignes directrices du Secrétarait du Conseil du Trésor;
-
Il repose sur le resultat stratégique et sur l'architecture desactivités de programme du ministčre approuvés par le Conseil du Trésor;
-
Il présente une information cohérente, complčte, équilibrée et fiable;
-
Il fournit une base pour la reddition de comptes ŕ l'égard des résultats obtenus avec les ressources et les autorisations qui lui sont confiées; et
-
Il rend compte dela situation financičre en fonction des montants approuvés des budgets des dépenses et dans Comptes publics du Canada.

Brien G. Benoit, M.D.
Président
Renseignements sommaires
Raison d'ętre du ministčre
Le mandat du CEPMB comporte les deux volets suivants :
| Réglementation | Exercer un contrôle sur les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés pour que ces prix ne soient pas excessifs afin de protéger les intéręts des consommateurs et de contribuer au régime de santé canadien. |
| Rapport | Faire rapport des tendances des prix des médicaments ainsi que des dépenses de R-D au Canada des titulaires de brevets pharmaceutiques afin d'éclairer les processus de prise de décisions et d'élaboration des politiques. |
Le CEPMB est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 dans la foulée des modifications apportées (projet de loi C-22) ŕ la Loi sur les brevets qui ont prolongé la durée de la protection accordée aux médicaments brevetés. Le CEPMB constitue une composante stratégique de la politique du gouvernement fédéral dont l'objectif est d'assurer un juste équilibre entre la protection des intéręts des consommateurs et la prestation de soins de santé ŕ des coűts abordables dans le plus grand respect des objectifs de développement commercial et industriel des lois visant les brevets pharmaceutiques.
Les révisions apportées en 1993 (projet de loi C-91) ŕ la Loi sur les brevets (la Loi) ont amélioré la protection accordée aux médicaments brevetés en éliminant le régime de licences obligatoires. Elles ont également élargi l'autorité du CEPMB en matičre d'application et placé l'organisme sous la responsabilité du ministre de la Santé. Auparavant, le CEPMB relevait du ministre de la Consommation et des corporations (devenu le ministčre de l'Industrie) qui est actuellement chargé de l'application générale de la Loi. Le ministre de la Santé est pour sa part responsable de l'application des articles 79 ŕ 103 de la Loi, lesquels régissent spécifiquement les produits pharmaceutiques.
Ressources financičres (en milliers de dollars)
| 2006-2006 | ||
| Dépenses prévues | Total des autorisations | Dépenses réelles |
| 6 512,0 $ | 11 690,0 $1 | 7 365,3 $2 |
Ressources humaines
| 2006-2007 | ||
| Prévues | Réelles | Différence |
| 48 | 43 | 5 |
| Statut du rendement | 2006-2007 | |||
| Résultat stratégique : Les prix exigés par les fabricants des médicaments brevetés vendus au Canada ne sont pas excessifs. |
||||
| Résultat recherché par le gouvernement du Canada : Population canadienne en santé. |
||||
| Priorité | Activité du programme - Résultats escomptés | Rendement obtenu | Montant prévu au budget (milliers $) | Montant dépensé (milliers $) |
| Priorité no 1 Conformité et application |
Activité : Résultats escomptés |
Résultats escomptés atteints Le Conseil a émis un guide de discussion sur ses Lignes directrices et tenues des ren-contres avec ses interve-nants. Les travaux se poursuivent. |
3 107,0 | 5 551,9 |
| Priorité no 2 Rapport sur les tendances des prix des médicaments |
Activité : Résultats escomptés : |
atteints | 1 455,0 | 1 016,8 |
|
Activité : Résultats escomptés : |
atteints | 1 350,0 | 557,3 | |
| Priorité no 2 Rapport sur les tendances des prix des médicaments (suite) |
Activité : Résultats escomptés : |
atteints | 600,0 | 239,3 |
Rendement global
Mandat et compétence
Le CEPMB est investi de deux rôles :
Réglementation : Exercer un contrôle sur les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés pour que ces prix ne soient pas excessifs afin de protéger les intéręts des consommateurs et de contribuer au régime de santé canadien.
| Le CEPMB passe en revue les prix départ-usine des médicaments brevetés, ŕ savoir les prix auxquels les brevetés vendent au Canada leurs médicaments brevetés pour usage humain ou pour usage vétérinaire distribués sous ordonnance ou en vente libre. Le CEPMB s'assure également que ces prix ne sont pas excessifs. | |
| Le CEPMB n'est pas habilité ŕ exercer un contrôle sur les prix des médicaments non brevetés. Il n'a pas non plus droit de regard sur les prix de vente au gros et au détail ni sur les honoraires des pharmaciens. |
Rapports : Faire rapport des tendances des prix des médicaments ainsi que des dépenses de R-D au Canada des titulaires de brevets pharmaceutiques afin d'éclairer les processus de prise de décisions et d'élaboration des politiques.
| Par ailleurs, en vertu de l'article 90 de la Loi, le ministre de la Santé a confié au Conseil les deux nouvelles responsabilités suivantes : |
-
Systčme national d'information sur l'utilisation des médicaments prescrits (SNIUMP)
En 2001, en vertu d'une entente intervenue entre les ministres fédéral, provinciaux et territoriaux de la Santé, le ministre fédéral de la Santé a chargé le CEPMB d'effectuer des recherches sur les prix des médicaments d'ordonnance offerts sur le marché canadien, sur l'utilisation faite de ces médicaments et sur les tendances de leurs prix de maničre ŕ fournir au régime de soins de santé une vue plus globale de la façon dont les médicaments d'ordonnance sont utilisés au Canada et des sources d'augmentation des coűts. -
En 2005, le ministre de la Santé s'est fait le porte-parole de ses homologues de la Santé des provinces et des territoires en demandant au CEPMB d'exercer un suivi des prix des médicaments non brevetés distribués sous ordonnance et de faire rapport des tendances observées. Cette initiative permet de constituer une source fiable et centralisée d'information sur les prix des médicaments non brevetés qui sera particuličrement utile pour la Stratégie nationale sur les produits pharmaceutiques.
Enjeux, tendances et défis
Les médicaments sont une composante essentielle des soins de santé. En effet, les médicaments sont de plus en plus utilisés partout dans le monde, dont au Canada, et accaparent une part toujours plus grande des dépenses en santé. Par conséquent, les médicaments préoccupent tout particuličrement les consommateurs, les régimes d'assurance-médicaments et les gouvernements.
D'un autre côté, l'intéręt de l'industrie pharmaceutique ŕ mettre au point et ŕ commercialiser des médicaments révolutionnaires est étroitement associé au retour potentiel sur l'investissement.
Depuis peu, l'innovation au sein de l'industrie pharmaceutique semble prendre la forme d'améliorations technologiques - par exemple de nouvelles technologies d'administration des médicaments - et se distancier des nouveaux médicaments constituant une découverte et qui sont trčs populaires sur le marché. Par ailleurs, les stratégies de prix de l'industrie des médicaments de marque donnent ŕ penser que l'industrie se dirige vers un régime oů les prix seraient les męmes dans tous les pays.
De plus, se pose la question des ventes de médicaments du Canada sur le territoire des États-Unis. Męme si l'ampleur de ces ventes semble actuellement en régression, l'industrie demeure préoccupée par l'écart important entre les prix pratiqués au Canada et ceux pratiqués aux États-Unis. Les politiques de prix et de remboursement récemment adoptées en Europe ont également une incidence sur les stratégies de prix au Canada.
En juin 2006, le Groupe de travail ministériel F-P-T a publié un rapport intérimaire sur la Stratégie nationale sur les produits pharmaceutiques. Dans ce rapport, les ministres ont mentionné que les défis qui se posent et les occasions qui s'offrent au Canada dans le domaine de la gestion des produits pharmaceutiques gravitent autour des trois grands thčmes suivants : 1) Accessibilité 2) Innocuité, efficacité et utilisation adéquate; 3) Pérennité du régime. Au nombre des priorités, le Groupe de travail a retenu les prix et les achats de médicaments non brevetés distribués sur ordonnance. Cette priorité est plus difficile ŕ gérer en raison de la complexité des groupes de payeurs, des mesures d'incitation financičre et des intéręts.
Pour arriver ŕ bien relever les défis que pose l'évolution de l'environnement pharmaceutique, le CEPMB a de plus en plus besoin de comprendre le nouvel environnement pharmaceutique qui devient de plus en plus vaste tout en continuant de protéger les intéręts des consommateurs canadiens.
Le CEPMB a dű composer avec une augmentation marquée de sa charge de travail, dont :
-
une augmentation du nombre d'examens du prix des médicaments brevetés pour usage humain conjuguée ŕ une augmentation du nombre de brevetés qui ne soumettent pas leurs rapports dans les délais impartis
-
l'émission d'un nombre record d'Avis d'audience en vertu de la Loi sur les brevets, et
-
la nécessité de réviser en profondeur nos Lignes directrices sur les prix excessifs et de mener préalablement une consultation publique. Cette révision s'impose en raison des opinions récemment exprimées par les intervenants selon lesquelles les Lignes directrices ne paraissent plus appropriées compte tenu des nouvelles tendances et des récents développements observés.
Rendement : Faits saillants
-
En 2006, 1 181 médicaments brevetés pour usage humain et 48 médicaments brevetés pour usage vétérinaire étaient assujettis ŕ la compétence du Conseil.
-
En 2006, 99 nouveaux médicaments brevetés pour usage humain (au niveau du numéro d'identification de drogue - DIN)3 ont fait l'objet d'un rapport au CEPMB. De ce nombre, 29 médicaments, représentant 43 DIN, sont de nouvelles substances actives. En date du 31 mars 2007, l'examen de 79 des 99 nouveaux médicaments brevetés avait été effectué. De ces 79 médicaments, 68 ont été jugés conformes aux Lignes directrices et 11 sont sous enquęte.
-
Six nouveaux DIN pour usage vétérinaire ayant fait l'objet d'un rapport au Conseil en 2006 sont encore sous examen.
-
Le Conseil a émis huit Avis d'audience, portant ainsi ŕ dix le nombre d'audiences en cours. Les audiences dans les affaires des médicaments Dovobet et Nicoderm, ouvertes il y a quelques années, sont aujourd'hui encore en instance.
-
Le Conseil a approuvé cinq engagements de conformité volontaire, dont un en mai 2007 et un autre en juin 2007 alors qu'une audience avait cours. Ces deux derniers engagements ont ainsi mené ŕ la conclusion de deux des dix audiences susmentionnées.
-
Le CEPMB a publié différents rapports d'étude et d'analyse. Au titre du Systčme national d'information sur l'utilisation des médicaments prescrits, il a publié les Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes d'assurance-médicaments ainsi que L'Observateur des médicaments émergents. Au titre de l'initiative sur les prix des médicaments non brevetés distribués sous ordonnance, il a publié Tendances des prix pratiqués au Canada et dans les pays de comparaison ainsi que Tendances de la valeur des ventes au Canada et structure du marché et Marché des médicaments dont le brevet est récemment arrivé ŕ échéance.
Tendances des ventes, des prix et des dépenses dans la R-D
-
En 2006, la valeur des ventes au Canada des médicaments brevetés a augmenté de 3,7 % et totalisé 12 milliards de dollars. Ces derničres années, il y a eu fléchissement du taux annuel de croissance des ventes.
-
La part des ventes de médicaments brevetés par rapport ŕ l'ensemble des ventes a baissé en 2006, passant de 71,4 % qu'elle était en 2005 ŕ 68,1 % en 2006.
-
Ce sont les agents antinéoplasiques et les agents immunomodulateurs (pour la chimiothérapie) qui ont le plus contribué en 2006 ŕ l'augmentation de la croissance de la valeur des ventes de médicaments brevetés.
-
Les prix départ-usine des médicaments brevetés au Canada mesurés ŕ l'aide de l'Indice des prix des médicaments brevetés (IPMB) ont diminué d'une moyenne de 0,2 % en 2006. Cette légčre diminution est attribuable aux prix moins élevés chargés aux hôpitaux. Pendant la męme période, l'Indice des prix ŕ la consommation était de 2,0 %.
-
Les analyses selon la catégorie thérapeutique, la catégorie de clients, la province/territoire et les pays de comparaison ont révélé une trčs grande variabilité des prix.
-
En 2006, le ratio des prix pratiqués au Canada par rapport ŕ la médiane des prix pratiqués dans les pays de comparaison était légčrement sous la parité. Autrement dit, les prix des médicaments brevetés pratiqués au Canada étaient légčrement inférieurs ŕ la médiane des prix pratiqués dans les sept pays de comparaison nommés dans le Rčglement sur les médicaments brevetés, 1994 (ces pays sont la France, l'Allemagne, l'Italie, la Sučde, la Suisse, le Royaume-Uni et les États-Unis).
-
Les brevetés ont fait rapport de dépenses de R-D de 1,2 milliard de dollars pour 2006, soit 1,9 % de moins qu'en 2005. Cette diminution est en partie attribuable ŕ une diminution du nombre de brevetés ayant soumis un rapport au CEPMB, qui est passé de 80 en 2005 ŕ 72 en 2006. Les brevetés membres de Rx&D (Canada's Research-based Pharmaceutical Companies, l'association réunissant les fabricants de médicaments de marque) ont fait état en 2006 de dépenses de R-D totalisant 949 millions de dollars, ce qui représente une diminution de 8,7 % par rapport ŕ 2005 alors que ces dépenses totalisaient 1,0 milliard de dollars.
-
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a poursuivi sa descente, passant de 8,7 % en 2005 ŕ 8,1 % en 2006. Cette męme tendance a été observée au niveau des brevetés membres de Rx&D dont les ratios sont passés de 8,8 % ŕ 8,5 % au cours de la męme période.
SECTION II - ANALYSE DES ACTIVITÉS DU PROGRAMME PAR RÉSULTAT STRATÉGIQUE
Analyse des activités de programme
Résultat stratégique
Les prix exigés par les fabricants des médicaments brevetés vendus au Canada ne sont pas excessifs.
Nom de l'activité de programme :
Examen du prix des médicaments brevetés
Le CEPMB n'a qu'un seul programme : l'examen du prix des médicaments brevetés. Ce programme compte les deux priorités suivantes :
-
conformité et application
-
rapports sur les tendances des prix des médicaments
Les objectifs du programme sont de protéger les intéręts des consommateurs et de contribuer au régime canadien de soins de santé.
Ressources financičres (en milliers de dollars) :
| 2006-2007 | ||
| Dépenses prévues | Total des autorisations | Dépenses réelles |
| 6 512,0 $ | 11 690,0 $ | 7 365,3 $ |
Ressources humaines :
| 2006-2007 | ||
| Prévues | Réelles | Différence |
| 48 | 43 | 5 |
Priorité 1 : Conformité et application
Ressources financičres (en milliers de dollars) :
| 2006-2007 | ||
| Dépenses prévues | Total des autorisations | Dépenses réelles |
| 3 107,0 $ | 8 225,1 $ | 5 551,9 $ |
Ressources humaines
| 2006-2007 | ||
| Prévues | Réelles | Différence |
| 25 | 30 | (5) |
Examen des prix
Le CEPMB passe en revue les données sur les prix des médicaments brevetés nouveaux et existants, distribués sous ordonnance ou en vente libre au Canada et que les titulaires de brevet sont tenus de lui soumettre en vertu de la Loi sur les brevets (la Loi) et du Rčglement sur les médicaments brevetés, 1994 (le Rčglement). Le CEPMB s'assure ainsi que les brevetés ne vendent pas leurs médicaments ŕ des prix excessifs - ou, autrement dit, qu'ils sont conformes aux prix autorisés en vertu des Lignes directrices sur les prix excessifs (les Lignes directrices) adoptées par le Conseil. 4
Les Lignes directrices sur les prix excessifs tiennent compte des facteurs de détermination des prix mentionnés ŕ l'article 85 de la Loi. Elles ont été formulées en consultation avec différents intervenants, dont les ministres de la Santé des provinces et des territoires, des associations de consommateurs et des représentants du secteur pharmaceutique.
Le CEPMB fait l'examen du prix Ť départ-usine ť, soit le prix auquel le breveté vend son médicament sur le marché canadien. Cet examen couvre les prix auxquels les brevetés vendent leurs médicaments brevetés pour usage humain et pour usage vétérinaire distribués sous ordonnance ou en vente libre aux différentes catégories de clients5 de chaque province et territoire.
D'une façon sommaire, les Lignes directrices prévoient ce qui suit :
-
Les nouveaux médicaments sont classés selon qu'ils constituent une découverte/une amélioration importante, qu'ils apportent des bienfaits thérapeutiques modestes, minimes ou nuls par rapport aux médicaments existants ou, encore, qu'ils constituent une nouvelle forme posologique d'un médicament existant (extension de gamme).
-
Les prix des médicaments brevetés constituant une découverte ou une amélioration importante ne peuvent en rčgle générale ętre supérieurs ŕ la médiane des prix pratiqués dans les sept pays nommés dans le Rčglement (qui sont la France, l'Allemagne, l'Italie, la Sučde, la Suisse, le Royaume-Uni et les États-Unis).
-
Les prix des nouveaux médicaments brevetés qui apportent des bienfaits thérapeutiques modestes, minimes ou nuls par rapport aux médicaments existants ne peuvent ętre supérieurs au prix le plus élevé des médicaments existants comparables utilisés au Canada pour traiter la męme maladie ou les męmes symptômes.
-
Les prix des nouveaux médicaments brevetés qui sont en fait une nouvelle concentration ou une nouvelle forme posologique d'un médicament existant doivent présenter une relation raisonnable avec les prix des concentrations ou des formes posologiques de médicaments déjŕ offerts sur le marché canadien.
-
Les prix des médicaments ne peuvent augmenter davantage que l'Indice des prix ŕ la consommation (IPC).
-
Le prix au Canada d'un médicament breveté ne peut en aucun temps ętre plus élevé que le prix le plus élevé pratiqué pour le męme médicament dans les pays de comparaison nommés dans le Rčglement.
Le résultat escompté de l'activité d'examen du prix est que tous les prix départ-usine des médicaments nouveaux et existants offerts sur le marché canadien font l'objet d'un examen régulier, transparent et conforme aux Lignes directrices du Conseil sur les prix excessifs.
L'activité du programme appuie également la priorité du gouvernement qui est de favoriser la santé de sa population en lui assurant l'accčs aux médicaments brevetés ŕ des prix qui ne sont pas excessifs.
Les indicateurs démontrant que le CEPMB atteint les résultats escomptés pour son objectif stratégique sont les suivants :
-
Les prix des médicaments brevetés vendus au Canada sont presque tous conformes aux Lignes directrices.
-
Les prix des médicaments brevetés existants n'augmentent pas plus que l'IPC.
-
Les mesures de contrainte sont systématiquement appliquées pour que soient réduits les prix jugés supérieurs aux prix autorisés en vertu des Lignes directrices.
-
Les prix au Canada des médicaments brevetés se situent sous la médiane des prix pratiqués dans les pays de comparaison nommés dans le Rčglement.
Examen des prix des médicaments brevetés nouveaux pour usage humain, 2006
En 2006, 99 nouveaux médicaments pour usage humain6 (DIN) ont été lancés sur le marché canadien. De ce nombre, 29 médicaments, représentant 43 DIN, sont de nouvelles substances actives. En date du 31 mars 2007, l'examen de 79 des 99 nouveaux médicaments avait été effectué. De ces 79 médicaments, 68 ont été reconnus conformes aux Lignes directrices et 11 ont paru non conformes et ont été mis sous enquęte. Vingt des 99 nouveaux médicaments étaient encore sous enquęte aprčs le 31 mars 2007.
Examen des prix des médicaments brevetés pour usage humain
Au total, 1 082 médicaments brevetés existants (ou DIN) étaient vendus au Canada en 2006.7 De ce nombre :
-
973 DIN (89,9 %) ont été reconnus conformes aux Lignes directrices
-
les prix de lancement de 6 DIN ont fait l'objet d'une enquęte
- 2 enquętes ont été engagées en 2004
- 4 enquętes ont été engagées en 2005
-
les prix de 59 DIN ont fait l'objet d'une enquęte suite ŕ une augmentation de leur prix
- 2 ont été engagées en 2003
- 16 ont été engagées en 2005
- 41 ont été engagées en 2006
-
27 DIN font ou ont fait l'objet d'une audience en vertu de l'article 83 de la Loi (pour de plus amples renseignements, voir la rubrique Ť Activités quasi-judiciaires ť ŕ la page 25)
- 3 DIN portent sur le médicament Nicoderm (1999)
- 1 DIN porte sur le médicament Dovobet (2004)
- 6 DIN portent sur le médicament Adderall XR (2006)
- 3 DIN portent le médicament Risperdal Consta (2006)8
- 1 DIN porte sur le médicament Airomir (2006)9
- 1 DIN porte sur le médicament Copaxone (2006)
- 4 DIN portent sur le médicament Concerta (2006)
- 5 DIN portent sur le médicament Strattera (2007)
- 1 DIN porte sur le médicament Quadracel (2007)
- 1 DIN porte sur le médicament Pentacel (2007)
- 1 DIN porte sur le médicament Penlac (2007)
-
les prix de 17 DIN étaient encore sous examen.
Le tableau 1 présente un sommaire du statut des examens, de la conformité et des enquętes menées en 2006 sur les prix des médicaments brevetés pour usage humain nouveaux et existants.
Tableau 1
| Médicaments brevetés pour usage humain (DIN) vendus au Canada en 2006 - Statut de l'examen du prix en date du 31 mars 2007 | |||
| Nouveaux médicaments lancés sur le marché en 2006 | Médicaments existants | Total | |
| Total | 99 | 1 082 | 1 181 |
| Conforme aux Lignes directrices | 68 | 973 | 1 041 |
| Sous examen | 20 | 17 | 37 |
| Sous enquęte | 11 | 65 | 76 |
| Avis d'audience | - | 27 | 27 |
Médicaments brevetés dont l'examen du prix était pris en compte dans le Rapport sur le rendement de 2005-2006 : Mise ŕ jour des résultats
Dans le Rapport sur le rendement de l'an dernier on pouvait lire que 969 médicaments brevetés existants pour usage humain étaient offerts sur le marché canadien en 2005 et que les prix de 22 de ces médicaments étaient sous examen au moment d'aller sous presse. Les résultats des examens menés au cours de l'exercice 2005-2006 sont les suivants : les prix de six des 22 DIN ont été jugés conformes aux Lignes directrices, les prix de 10 DIN ont été jugés supérieurs ŕ la limite autorisée par les Lignes directrices et ont justifié une enquęte et les prix de 6 autres DIN sont encore sous examen. Ces médicaments sont comptabilisés dans le tableau 1 sous la rubrique des médicaments existants sous examen.
Le CEPMB mentionnait également dans son rapport de rendement pour l'exercice 2005-2006 que 37 DIN étaient alors sous enquęte. De ce nombre, 11 enquętes sont aujourd'hui closes; dans huit cas, les prix ont été jugés conformes aux Lignes directrices. Dans trois cas, les enquętes ont été interrompues suite ŕ l'approbation d'un Engagement de conformité volontaire : Eloxatin (2 DIN) et Hextend. (Voir la rubrique Ť Engagements de conformité volontaire ť ŕ la page 22.)
Médicaments brevetés pour usage vétérinaire
Le Conseil a adopté une politique d'examen du prix des médicaments brevetés pour usage vétérinaire différente de celle pour les médicaments pour usage humain. Comme le prévoient les Lignes directrices actuelles, le personnel du Conseil ne fait l'examen que des prix de lancement des médicaments pour usage vétérinaire afin de vérifier si leur prix est ou non excessif. Par la suite, les prix des médicaments pour usage vétérinaire ne font l'objet d'un examen que sur réception d'une plainte étoffée. Les titulaires de brevets liés ŕ des médicaments pour usage vétérinaire doivent toutefois garder en dossier leurs données sur les prix et sur les ventes de leurs médicaments au cas oů le personnel du Conseil demanderait ŕ les consulter. Le CEPMB n'a reçu en 2006 aucune plainte concernant le prix d'un médicament pour usage vétérinaire. Dans son rapport de l'an dernier, le CEPMB mentionnait que les prix de tous les médicaments brevetés nouveaux pour usage vétérinaire avaient été vérifiés et jugés conformes aux Lignes directrices.
En 2006, le médicament Paylean 20, distribué par Elanco Animal Health Canada, une division de Eli Lilly and Company, a été vendu sur un marché canadien avant d'avoir fait l'objet d'un rapport au CEPMB. En 2006, six nouveaux DIN ayant fait l'objet d'un rapport au CEPMB étaient sous examen. Vous trouverez les rapports sommaires de l'examen du prix de ces médicaments sur le site Web du CEPMB sous Ť Mandat de réglementation; Médicaments brevetés; Rapports sur les nouveaux médicaments brevetés pour usage vétérinaire ť.
Mesures d'application
Engagements de conformité volontaire
Un engagement de conformité volontaire est un engagement écrit pris par le breveté de baisser le prix de son médicament pour le rendre conforme au prix autorisé en vertu des Lignes directrices et de rembourser les recettes excessives tirées de la vente de son médicament ŕ un prix excessif.
En vertu de la Politique de conformité et d'application, les brevetés peuvent soumettre un Engagement de conformité volontaire męme si le personnel du Conseil est arrivé ŕ la conclusion, aux termes d'une enquęte, que le prix auquel le breveté a vendu son médicament au Canada semble supérieur au prix autorisé en vertu des Lignes directrices.
L'acceptation d'un Engagement de conformité volontaire par le président du Conseil constitue une alternative aux procédures quasi-judiciaires qui s'engagent suite ŕ l'émission d'un Avis d'audience. La politique du Conseil sur la conformité et l'application autorise la présentation d'un Engagement de conformité volontaire męme aprčs l'émission d'un Avis d'audience, mais ŕ ce point l'engagement doit ętre approuvé par le panel d'audience.
En 2006-2007, quatre engagements de conformité volontaire ont été acceptés pour les cinq médicaments brevetés suivants :10
NuvaRing, Organon Canada Ltée
Le médicament NuvaringMD est un nouveau contraceptif. Il s'agit d'un anneau vaginal souple et transparent ŕ libération lente.
Le 20 juin 2006, le vice-président du Conseil a approuvé l'engagement de conformité volontaire soumis par Organon Canada Ltée (Organon) pour son médicament NuvaRingMD. Aux termes de cet engagement, Organon a réduit le prix de transaction moyen de son médicament NuvaRingMD ŕ un niveau égal ou inférieur ŕ 13,6791 $, le prix maximum non excessif (MNE) établi pour 2006. Organon a remis au gouvernement du Canada les recettes excessives qui, d'aprčs les calculs du personnel du Conseil, ont totalisé 115 584,93 $ pour la période du 17 janvier au 31 juin 2005. Les recettes excessives encaissées au cours de la période du 1er juillet 2005 au 30 juin 2006 ont été remboursées au moyen d'une réduction du prix d'un autre médicament distribué par le breveté, en l'occurrence le RemeronRD 15 mg, 30 mg et 45 mg. Le prix du NuvaRingMD est assujetti ŕ l'examen du CEPMB jusqu'en 2018, soit jusqu'ŕ l'échéance de son brevet.
Eloxatin, sanofi-aventis Canada Inc.
Le médicament Eloxatin est indiqué pour traiter les patients souffrant d'un cancer métastatique du colon ou du rectum qui a resurgi ou qui a progressé durant la thérapie de premičre ligne en association avec le bolus 5-FU/LV et l'irinotecan ou, encore, dans les six mois suivant celle-ci.
Le 14 juillet 2006, le président du Conseil a approuvé l'engagement de conformité volontaire soumis par sanofi-aventis Canada Inc. (sanofi-aventis) pour son médicament Eloxatin. Aux termes de cet engagement, sanofi-aventis a reconnu que, pour la période de lancement, le prix maximum non excessif de la fiole de 50 mg de Eloxatin est 430,9208 $ et de 922,6750 $ pour la fiole de 100 mg. Pour 2006, ces prix sont de 490,5901 $ pour la fiole de 50 mg et de 1 030,0175 $ pour la fiole de 100 mg. En lieu d'une réduction du prix de la fiole et pour éviter une distorsion de la relation entre le prix de la fiole de 50 mg et le prix de la fiole de 100 mg, sanofi-aventis s'est engagé ŕ maintenir ŕ 1 000 $ le prix de la fiole de 100 mg tant et aussi longtemps que le prix MNE de la fiole de 50 mg n'aura pas atteint 500 $. Pour rembourser les recettes excessives tirées de la vente du médicament breveté Eloxatin ŕ des prix excessifs, sanofi-aventis a fait des paiements totalisant 1 767 078,84 $ ŕ des hôpitaux, des centres anticancéreux et des organismes de lutte contre le cancer qui ont acheté son médicament ŕ des prix jugés excessifs. Le montant des remises a été établi au prorata des achats du médicament effectués aux quatre coins du pays jusqu'en date du 31 mars 2006 inclusivement. Le prix du médicament breveté Eloxatin est assujetti ŕ la compétence du CEPMB au moins jusqu'ŕ la fin de la période de rapport allant de janvier ŕ juin 2019.
Hextend, Hospira Healthcare Corporation
Le médicament Hextend est indiqué pour le traitement de l'hypovolémie lorsque le volume plasmatique doit ętre augmenté.
Le président du Conseil a approuvé le 14 juillet 2006 l'engagement de conformité volontaire pour le médicament Hextend. Hospira Healthcare Corporation (Hospira) a reconnu que le prix MNE d'un millilitre de son médicament est 0,0858 $ pour 2004 et pour 2005. Hospira veillera ŕ ce que le prix de transaction moyen de son médicament ne dépasse plus le prix MNE - si le prix du médicament Extend aux États-Unis exprimé dans la devise du pays ne change pas ou augmente, le prix MNE sera le moindre prix entre le prix rajusté pour tenir compte de l'IPC et 0,0858 $ le mL, et si le prix du médicament aux États-Unis exprimé dans la devise du pays diminue, une comparaison des prix internationaux utilisant le nouveau prix pratiqué aux États-Unis sera effectuée pour établir, comme le prévoient les Lignes directrices, un nouveau prix MNE. Hospira a également accepté que le prix de transaction moyen de son médicament en 2006 se situe dans les limites du prix MNE de son médicament pour 2006. Enfin, Hospira a remboursé les recettes excessives qu'il a tirées entre le 15 mars et le 31 décembre 2004 de la vente de son médicament ŕ un prix excessif en remettant au gouvernement du Canada la somme de 8 823,60 $. Le prix du médicament Hextend sera assujetti ŕ l'examen du CEPMB jusqu'en 2014 alors que le brevet lié ŕ ce médicament arrivera ŕ échéance.
Airomir, 3M Canada Company
Le médicament Airomir est indiqué pour le traitement de l'asthme, de la bronchite chronique et d'autres troubles respiratoires.
Au début de l'année 2007, le Conseil a approuvé l'engagement de conformité volontaire négocié par 3M Canada Company (3M Canada) et le personnel du Conseil et prévoyant le paiement de toutes les recettes excessives tirées de la vente du médicament Airomir ŕ un prix excessif entre le 1er janvier 2004 et le 29 décembre 2006. Le personnel du Conseil a estimé ŕ 485 498,58 $ le montant des recettes excessives. Le panel du Conseil a mis fin aux procédures engagées suite ŕ l'émission d'un Avis d'audience. Le 20 février 2006, le Conseil avait émis un Avis d'audience sur la base des allégations formulées par le personnel du Conseil selon lesquelles 3M Canada a vendu son médicament Airomir ŕ des prix supérieurs aux prix autorisés en vertu des Lignes directrices. Le Conseil a tenu une conférence préparatoire ŕ l'audience le 19 mai 2006 en prévision de l'audience qui devait débuter le 19 octobre suivant. Ŕ la demande de 3M Canada, l'audience a été reportée. Le Conseil a plus tard été informé que le 29 décembre 2006 3M Canada avait vendu ses droits de commercialisation du médicament Airomir ŕ Graceway Canada (Graceway). Le 9 mai 2007, le Conseil a reçu une demande d'approbation d'un engagement de conformité volontaire qui réglait les différents points de litige soulevés dans l'Avis d'audience.
Aux fins de l'application des Lignes directrices sur les prix excessifs, Graceway est en date du 29 décembre 2006 le titulaire du brevet lié au médicament Airomir. Ainsi, en vertu du Rčglement sur les médicaments brevetés, 1994, Graceway doit présenter au CEPMB un rapport semestriel sur les prix et sur les ventes de son médicament ainsi qu'un rapport annuel sur ses dépenses de R-D.
Risperdal Consta, Janssen-Ortho Inc.
Le médicament Risperdal Consta est indiqué pour l'atténuation des manifestations de schizophrénie et des troubles psychotiques associés.
En juin 2007, le Conseil a approuvé l'engagement de conformité volontaire que le personnel du Conseil a négocié avec Janssen-Ortho Inc. (Janssen-Ortho). Aux termes de cet engagement, Janssen-Ortho a accepté les prix MNE établis pour son médicament pour les années 2004, 2005, 2006 et 2007 et a remboursé les recettes tirées de la ventes de son médicament ŕ des prix excessifs en remettant la somme de 4 386 172,99 $ ŕ Sa Majesté la reine du chef du Canada. Le 30 janvier 2006, le Conseil avait émis un Avis d'audience dans l'affaire de Janssen-Ortho et du prix de son médicament Risperdal Consta. L'audience s'est déroulée en 2006 et en 2007. Le 4 juillet 2007, le panel d'audience du Conseil a accepté l'engagement de conformité volontaire qui lui a soumis Janssen-Ortho et ainsi mis fin ŕ la procédure d'audience.
Activités quasi-judiciaires - Audiences
En vertu de l'article 83 de la Loi, le Conseil peut tenir une audience publique aux fins de déterminer si un médicament breveté est ou a été vendu sur un marché canadien ŕ un prix excessif et, le cas échéant, rendre une ordonnance enjoignant le breveté de réduire le prix de son médicament et de rembourser la portion excessive des recettes qu'il a tirées de la vente de son médicament ŕ un prix excessif.
Entre janvier 2006 et le 31 mars 2007, le Conseil a émis huit Avis d'audience. Le nombre d'audiences en instance a ainsi été porté ŕ dix.11 Par rapport aux autres années, il s'agit bien d'une augmentation du nombre d'audiences. Ŕ titre de comparaison, ce nombre correspond au nombre total d'avis d'audiences que le Conseil a émis entre 1987, l'année de sa création, et 2005. En ce qui concerne les huit Avis d'audience émis avant 2006, une affaire a été menée ŕ terme, cinq ont été réglées au moyen d'un Egagement de conformité volontaire et deux - le Dovobet et le Nicoderm - sont encore en instance et sont comptabilisées dans les 10 audiences mentionnées.
Cette augmentation du nombre d'audiences peut s'expliquer par des facteurs tels que l'apparition sur le marché de nouveaux médicaments qui ont délogé les nouvelles substances chimiques largement utilisées et l'influence d'une démarche visant ŕ uniformiser les prix ŕ l'échelle internationale. Elle peut également ętre partiellement associée aux augmentations récentes des prix, brisant une assez longue période de stabilité. L'objet de ces audiences est de déterminer si, en vertu des articles 83 et 85 de la Loi, les brevetés vendent ou ont vendu leurs médicaments sur un marché au Canada ŕ des prix que le Conseil juge excessifs et, le cas échéant, de décider de l'ordonnance qu'il y a lieu de rendre.
Adderall XR, Shire BioChem Inc.
Le médicament Adderall XR est indiqué pour le traitement du trouble d'hyperactivité avec déficit de l'attention.
Le 18 janvier 2006, le Conseil a émis un Avis d'audience dans l'affaire de Shire Biochem Inc. (Shire) et du prix de son médicament breveté Adderall XR.
Le 15 décembre 2006, le Conseil a rendu sa décision sur la question du brevet en instance. Shire a déposé une requęte dans laquelle il demandait au Conseil de modifier son Avis d'audience de maničre ŕ limiter son enquęte ŕ la période subséquente ŕ l'émission du brevet 2,348,090, lequel a été attribué le 13 avril 2004. Le Conseil a rejeté la requęte de Shire qui a répliqué en demandant ŕ la Cour fédérale du Canada d'effectuer une révision judiciaire de la décision rendue par le Conseil. La cause n'a pas encore été entendue.
Le Conseil a entendu le 18 juin 2007 le plaidoyer final sur le fond de la cause, mais il n'a pas encore rendu sa décision.
Airomir, 3M Canada Company
Le médicament Airomir est indiqué pour traiter l'asthme, la bronchite chronique et autres troubles broncho-pulmonaire.
Le 20 février 2006, le Conseil a émis un Avis d'audience dans l'affaire de 3M Canada Company (3M Canada) et le prix de son médicament breveté Airomir.
Le 14 mai 2007, le panel d'audience du Conseil a approuvé l'Engagement de conformité volontaire12 prévoyant le rčglement des différentes questions alléguées dans l'Avis d'audience.
Concerta, Janssen-Ortho Inc.
Le médicament Concerta est indiqué pour le traitement des troubles d'hyperactivité avec déficit de l'attention.
Le 24 juillet 2006, le Conseil a émis un Avis d'audience dans l'affaire de Janssen-Ortho Inc. (Janssen-Ortho) et de son médicament breveté Concerta.
Le panel d'audience, qui a entendu les plaidoyers finaux le 29 aoűt 2007, n'a pas encore rendu sa décision.
Copaxone, Teva Neuroscience G.P.-S.E.N.C.
Le Copaxone, présenté sous la forme d'une seringue de 20 mg/1,0 mL du médicament, est une nouvelle forme posologique d'un composé existant (acétate de glatiramčre) indiqué pour réduire la fréquence des rechutes chez les malades en traitement ambulatoire atteints de la sclérose en plaques ŕ périodes progressives et rémittentes.
Le 8 mai 2006, le Conseil a émis un Avis d'audience dans l'affaire de Teva Neuroscience G.P.-S.E.N.C. (Teva) et du prix de son médicament breveté Copaxone.
Le panel d'audience, qui a entendu les plaidoyers finaux le 13 aoűt 2007, n'a pas encore rendu sa décision.
Dovobet, LEO Pharma Inc.
Le Dovobet est un médicament indiqué pour le traitement topique du psoriasis.
Le 29 novembre 2004, le Conseil a émis un Avis d'audience dans l'affaire de LEO Pharma Inc. (LEO Pharma) et le prix de son médicament breveté Dovobet. L'audience a pris fin en décembre 2005 et le panel d'audience a rendu sa décision le 19 avril 2006.
Le 19 avril 2006, LEO Pharma a soumis ŕ la Cour fédérale du Canada une requęte en révision judiciaire de la décision rendue par le Conseil. La Cour fédérale a tenu une audience le 12 février 2007 et a rendu sa décision et ses motifs. Le panel d'audience du Conseil n'a pas encore rendu son ordonnance finale.
Nicoderm, Hoechst Marion Roussel Canada Inc.
Le médicament Nicoderm est un timbre transdermique de nicotine indiqué pour atténuer les symptômes d'assuétude chez les personnes qui cessent de fumer.
Le 20 avril 1999, le Conseil a émis un Avis d'audience dans l'affaire de Hoechst Marion Roussel Canada Inc. (HMRC) et le prix de son médicament breveté Nicoderm. Le 25 mai 1999, HMRC a déposé une requęte demandant au Conseil d'annuler son Avis d'audience. Le panel d'audience a rendu une premičre décision concernant cette requęte le 3 aoűt 1999 et une deuxičme, le 8 aoűt 2000.
Le 3 septembre 1999, HMRC a demandé une révision judiciaire de la premičre décision du Conseil et plus tard de la deuxičme. La Cour fédérale a rendu sa décision dans cette affaire le 17 novembre 2005. Le panel d'audience n'a pas encore rendu sa décision.
Penlac - vernis ŕ ongles, sanofi-aventis Canada Inc.
Le médicament Penlac est une nouvelle formulation d'un composé existant (le ciclopirox). Il est indiqué pour le traitement des ongles des patients immunocompétents atteints d'une onychomycose ou infection fongique des ongles ne touchant pas la lunule (causée par le Trichophyton rubrum).
Le 26 mars 2007, le Conseil a émis un Avis d'audience dans l'affaire de sanofi-aventis Canada Inc. (sanofi-aventis) et du prix de son médicament breveté Penlac. Une conférence préparatoire a eu lieu le 6 juin 2007 et l'audience est en instance.
Quadracel et Pentacel, sanofi pasteur Limitée
Le médicament Quadracel est indiqué pour la promovaccination des nourrissons de 2 mois et plus et comme vaccin de rappel pour les enfants d'au plus 7 ans contre la diphtérie, le tétanos, la coqueluche et la poliomyélite.
Le médicament Pentacel est indiqué pour l'immunisation systématique des enfants de 2 ŕ 59 mois contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et l'haemophilus influenzae de type b. Le médicament est vendu au Canada sous la forme d'une fiole monodose de Act HIB (poudre lyophilisée pour injection) et d'une ampoule ŕ dose unique (0,5 ml) de Quadracel (suspension pour injection).
Le 27 mars 2007, le Conseil a émis un Avis d'audience dans l'affaire de sanofi-pasteur Limitée (sanofi-pasteur) et des prix de ses médicaments brevetés Quadracel et Pentacel.
La conférence préparatoire doit avoir lieu le 31 octobre 2007 et l'audience du 28 au 30 novembre 2007.
Risperdal Consta, Janssen-Ortho Inc.
Le médicament Risperdal Consta est une nouvelle formulation d'un composé existant (le risperidone) indiqué pour le traitement des manifestations de schizophrénie et des troubles psychotiques associés.
Le 30 janvier 2006, le Conseil a émis un Avis d'audience dans l'affaire de Janssen-Ortho Inc. (Janssen-Ortho) et du prix de son médicament breveté Risperdal Consta. L'audience a eu lieu en 2006 et en 2007. Le 4 juillet 2007, le panel d'audience du Conseil a accepté l'engagement de conformité volontaire que lui a soumis Janssen-Ortho et a mis fin ŕ la procédure.
Strattera, Eli Lilly Canada Inc.
Le médicament Strattera est indiqué pour le traitement du trouble déficitaire de l'attention chez les enfants d'au moins 6 ans, les adolescents et les adultes.
Le 15 décembre 2006, le Conseil a émis un Avis d'audience dans l'affaire de Eli Lilly Canada Inc. (Eli Lilly) et du prix de son médicament Strattera. Le 22 février 2007, le panel d'audience du Conseil a tenu une audience sur la requęte d'ajournement déposée par Eli Lilly. Dans une décision verbale qu'il a rendue, le Conseil a rejeté la requęte. L'audience est en instance.
Consultations
Modifications du Rčglement sur les médicaments brevetés, 1994
Le 31 décembre 2005, les modifications proposées au Rčglement sur les médicaments brevetés, 1994 ont été publiées dans la Partie I de la Gazette du Canada. Suite ŕ cette publication, des intervenants ont fait parvenir des mémoires au Conseil qui en a pris connaissance avec beaucoup d'intéręt.
Au printemps 2006, aprčs avoir pris connaissance des révisions proposées au projet de modifications du Rčglement, le personnel du Conseil a rencontré des représentants de Rx&D. En février et en mars 2007, le personnel du Conseil a de nouveau rencontré les représentants de Rx&D ainsi que les représentants de l'Association canadienne des médicaments génériques et de BIOTECanada. Le projet de modifications au Rčglement suit son cours.
Examen des Lignes directrices sur les prix excessifs
En 2005, le Conseil a publié un document de discussion sur les augmentations des prix des médicaments. Les préoccupations exprimées par certains intervenants portaient sur l'augmentation des prix étant essentiellement attribuable aux prix de lancement. La publication en mai 2006 du Guide de discussion aux fins de la consultation sur les Lignes directrices du Conseil sur les prix excessifs a constitué la premičre étape de l'initiative d'examen des Lignes directrices sur les prix excessifs. Le Guide a invité les intervenants ŕ exprimer leurs points de vue concernant les trois sujets suivants : le classement des nouveaux médicaments, les tests appliqués au prix de lancement et l'interprétation aux fins de l'examen du prix l'expression Ť sur un marché ť mentionnée dans la Loi. Le Conseil a reçu 45 mémoires dans lesquels des intervenants et des groupes d'intervenants ont exprimé différents points de vue concernant les Lignes directrices : brevetés, représentants d'associations de patients et de fournisseurs de soins de santé, de régimes publics et privés d'assurance-médicaments, membres du Groupe consultatif sur les médicaments pour usage humain, chercheurs en milieu universitaire et experts-conseils.
En novembre 2006, le Conseil a convié environ 140 de ses intervenants ŕ une des séances de discussion tenues ŕ Edmonton, Montréal, Toronto, Halifax et Ottawa. Les participants ont discué du classement des médicaments dans les catégories, de l'interprétation de l'expression Ť sur un marché ť ainsi que de deux nouveaux sujets, ŕ savoir la révision du prix de référence et les principes qui pourraient guider l'application au processus d'examen du prix des facteurs de fixation des prix mentionnés dans la Loi. (Vous trouverez le Guide et les sommaires des discussions sur le site Web du CEPMB (www.pmprb-cepmb.gc.ca) sous Ť Consultations; Consultations sur les Lignes directrices du Conseil sur les prix excessifs, Documents de référence ť.
Les Lignes directrices cherchent ŕ rendre le processus d'examen du prix encore plus transparent et plus prévisible pour les intervenants. Le Conseil reconnaît que l'environnement pharmaceutique a beaucoup changé depuis 1994, année de la derničre révision en profondeur des Lignes directrices sur les prix excessifs, et qu'il importe aujourd'hui de s'assurer qu'elles sont encore justes et pertinentes. Il faut également reconnaître que les Lignes directrices ont jusqu'ici bien réussi ŕ encourager la conformité volontaire en amenant les brevetés ŕ ne pas vendre leurs médicaments ŕ des prix excessifs. Ŕ l'heure actuelle, plus de 1 100 médicaments brevetés sont assujettis ŕ la compétence du Conseil en matičre d'examen du prix. Męme s'il a dű émettre des Avis d'audience et si plusieurs enquętes sur des prix excessifs ont été engagées en 2006, le taux de conformité des médicaments brevetés aux Lignes diectrices est quand męme trčs élevé, se situant ŕ plus de 90 %.
Le Conseil poursuit son analyse en 2007. Dans leur forme actuelle, les Lignes directrices ne traitent pas de tous les facteurs mentionnés dans la Loi et dont le Conseil doit tenir compte au moment de déterminer si le prix d'un médicament breveté est ou non excessif. Par exemple, les Lignes directrices sont muettes concernant l'examen de la deuxičme partie de l'alinéa 85 (1)(c) qui se lit comme suit : Ť le prix de vente du médicament et d'autres médicaments de la męme catégorie thérapeutique ŕ l'étranger ť.
Les Lignes directrices ne traitent pas non plus de l'application du paragraphe 85 (2) - Ť Si, aprčs avoir tenu compte de ces facteurs, il est incapable de décider si le prix d'un médicament vendu sur un marché canadien est excessif, le Conseil peut tenir compte des facteurs suivants : a) les coűts de réalisation et de mise en marché, et b) tous les autres facteurs précisés par les rčglements d'application du présent paragraphe ou qu'il estime pertinents ť. Les Lignes directrices actuelles ne donnent aucune indication de ce qu'il faut faire lorsqu'il n'est pas possible, en vertu du paragraphe 85 (1), de déterminer si le prix d'un médicament est ou non excessif, sur la façon d'évaluer les coűts de fabrication et de commercialisation du médicament et autres facteurs pertinents.
Ces lacunes se sont imposées ŕ l'examen des Lignes directrices dans leur forme actuelle. Tel que l'a annoncé La Nouvelle dans sa livraison d'avril 2007, le Conseil prévoit tenir des consultations bilatérales savec des groupes représentant les différents secteurs de l'industrie pharmaceutique, les gouvernements fédéral, provinciaux et territoriaux et les consommateurs au cours de l'été 2007.
Priorité 2 : Rapport sur les tendances des prix des produits pharmaceutiques
Ressources financičres (en milliers de dollars) :
| 2006-2007 | ||
| Dépenses prévues | Total des autorisations | Dépenses réelles |
| 3 405,0 $ | 3 464,9 $ | 1 813,4 $ |
Ressources humaines :
| 2006-2007 | ||
| Prévues | Réelles | Différence |
| 23 | 13 | 10 |
Tendances des prix
La deuxičme priorité du CEPMB est de faire rapport des tendances des prix de tous les médicaments ainsi que des dépenses des titulaires de brevets pharmaceutiques dans la recherche-développement. Par cette priorité, le Conseil aide ses intervenants ŕ prendre des décisions éclairées et ŕ se doter de politiques pertinentes.
L'article 100 de la Loi sur les brevets oblige le Conseil ŕ soumettre chaque année au ministre de la Santé un rapport sur ses activités de l'exercice précédent. Ce rapport doit présenter un sommaire des tendances des prix pratiqués par l'industrie pharmaceutique ainsi que des dépenses des brevetés en recherche-développement par rapport aux recettes tirées de leurs ventes au Canada. Le ministre de la Santé doit ŕ son tour déposer le rapport en Chambre.
Le CEPMB compile l'Indice des prix des médicaments brevetés (IPMB). Cet indice permet au CEPMB d'observer les tendances des prix des médicaments brevetés et d'en faire rapport. L'IPMB mesure la variation moyenne par rapport ŕ l'année précédente des prix auxquels les fabricants vendent leurs médicaments brevetés sur le marché canadien. L'IPMB ne mesure pas les effets des changements de l'utilisation faite des médicaments sur les dépenses en médicaments. Cette mesure est prise ŕ l'aide d'un autre indice appelé l'Indice du volume des ventes des médicaments brevetés (l' IVVMB). L'IPMB ne mesure pas non plus l'incidence sur les coűts des nouvelles habitudes d'ordonnance des médicaments ou de l'introduction de nouveaux médicaments. L'IPMB a été conçu pour isoler la composante de variation des ventes attribuable aux variations des prix des médicaments brevetés.
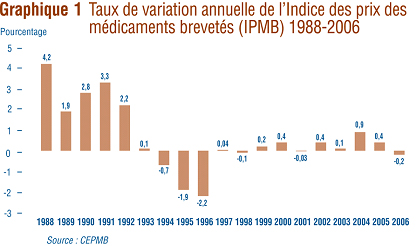
Le graphique 1 présente les variations annuelles de l'IPMB pour les années 1988 ŕ 2006. Selon la mesure prise par l'IPMB, les prix des médicaments brevetés paratiqués par les brevetés ont augmenté en moyenne de 0,2 % en 2006. Ce léger recul de l'IPMB fait suite ŕ deux années d'augmentations assez marquées.
Comparaisons de l'IPMB et de l'IPC
L'article 85 de la Loi sur les brevets (la Loi) prévoit que le CEPMB doit tenir compte des variations de l'Indice des prix ŕ la consommation (IPC) lorsqu'il est appelé ŕ déterminer si le prix d'un médicament breveté est ou non excessif.
Le graphique 2 présente les variations annuelles de l'IPMB par rapport aux variations de l'IPC pour les męmes années. L'inflation des prix, mesurée ŕ l'aide de l'IPC, a été supérieure ŕ l'augmentation moyenne des prix des médicaments brevetés presque chaque année depuis 1988, exception faite de 1992 oů le taux d'inflation prévu (ŕ la lumičre duquel les brevetés fixent les augmentations de leurs prix) a été largement supérieur au taux d'inflation réel. La situation s'est répétée en 2006 alors que l'IPC a augmenté de 2,0 % et que l'IPMB a reculé de 0,2 %. Il n'est pas surprenant que l'IPMB n'ait pas augmenté au męme rythme que l'IPC. Les Lignes directrices du Conseil sur les prix excessifs prévoient que les prix des médicaments brevetés ne peuvent augmenter davantage que le taux moyen d'augmentations de l'indice des prix ŕ la consommation sur une période de trois ans. (Les Lignes directrices limitent également les augmentations annuelles de prix ŕ une fois et demie le taux d'inflation calculé ŕ l'aide de l'IPC. En théorie, il peut s'ensuivre une situation oů l'IPMB augmenterait davantage que l'inflation mesurée ŕ l'aide de l'IPC, mais elle ne s'est encore jamais produite.)
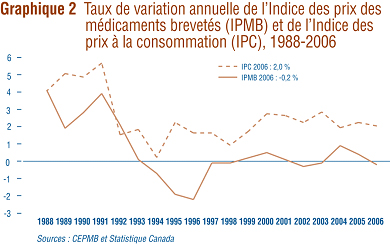
Ces exigences ont pour effet de limiter les augmentations de l'IPMB sur toute période de trois années. En pratique, les variations de l'IPMB n'atteignent jamais cette limite étant donné que certains brevetés n'augmentent pas les prix de leurs médicaments dans toute la mesure autorisée en vertu des Lignes directrices du CEPMB.
Variation des prix selon le groupe thérapeutique principal
Le tableau 2 présente les taux moyens de variation des prix des médicaments brevetés selon leur groupe thérapeutique principal du Systčme Anatomique, Thérapeutique et Chimique (systčme ATC) de l'Organisation mondiale de la santé. Ce tableau a été établi en appliquant la méthode de calcul de l'IPMB aux données sur les prix des différents médicaments brevetés ventilés par groupe thérapeutique principal. Le tableau présente aussi la part des ventes de tous les médicaments brevetés appartenant aux différents groupes thérapeutiques ainsi que le taux moyen de variation des prix. La derničre colonne du tableau présente le résultat de la multiplication du taux de variation des prix des médicaments du goupe par sa part de l'ensemble des ventes, ce qui donne une mesure approximative de la variation générale de l'IPMB attribuable aux médicaments du groupe thérapeutique correspondant.
Selon cette mesure, ce sont les agents antinéoplasiques et les agents immunomodulateurs qui, en 2006, ont le plus contribué ŕ la variation des prix avec une baisse de 0,3 %.
Tableau 2
| Variation de l'IPMB selon le groupe thérapeutique principal, 2006 | |||
| Groupe thérapeutique | Pourcentage des ventes(%) | Taux de variation 2005-2006(%) | Contribution ŕ la variation de l'IPMB(%) |
| A : Tube digestif et métabolisme | 13,0 | -0,5 | -0,1 |
| B : Sang et organes sanguinoformateurs | 6,7 | -1,1 | -0,1 |
| C : Systčme cardiovasculaire | 25,6 | 0,2 | 0,0 |
| D : Produits dermatologiques | 0,8 | 1,3 | 0,0 |
| G : Systčme génito-urinaire et hormones sexuelles | 3,2 | 1,1 | 0,0 |
| H : Préparations hormonales systémiques | 0,9 | -2,1 | 0,0 |
| J : Antiinfectieux généraux et pour usage et P : Produits antiparasitaires 13 | 9,7 | 0,2 | 0,0 |
| L : Agents antinéoplasiques et immunomodulateurs | 12,8 | -2,4 | -0,3 |
| M : Systčme musculo-squelettique | 3,9 | 0,5 | 0,0 |
| N : Systčme nerveux | 15,1 | 0,3 | 0,1 |
| R : Systčme respiratoire | 6,7 | 1,0 | 0,1 |
| S : Organes sensoriels | 1,2 | 0,4 | 0,0 |
| V : Divers | 0,6 | -3,6 | 0,0 |
| Total | 100,0* | -0,2 | |
| Source : CEPMB * Le total peut ne pas correspondre ŕ 100,0, certains chiffres ayant été arrondis. |
|||
Variation des prix selon la catégorie de clients
Le graphique 3 présente les taux moyens de variation des prix selon la catégorie de clients.14 Ces taux ont été obtenus en appliquant la méthodologie du calcul de l'IPMB aux données sur la valeur des ventes de médicaments brevetés ventilées entre les ventes aux hôpitaux, aux pharmacies et aux grossistes15.
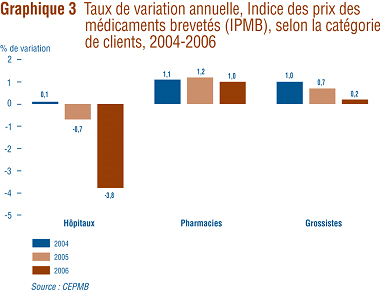
En 2006, la variation des prix ont fluctué entre 1,0 % (ventes directes aux pharmacies) et -3,8% (ventes aux hôpitaux) par rapport aux taux de 2005. On remarquera que le taux de variation de la valeur des ventes aux grossistes (qui accaparent prčs des trois quarts des ventes) est ŕ peu prčs le męme que le taux de variation de l'IPMB. Aucune catégorie de clients n'a enregistré un taux de variation de prix largement inférieure ŕ l'inflation mesurée ŕ l'aide de l'IPC.
D'aprčs ce qu'on peut voir sur le graphique 3, la baisse légčre de l'IPMB est attribuable aux prix plus bas payés par les hôpitaux : si l'IPMB n'avait couvert que les ventes faites aux pharmacies et aux grossistes, il n'aurait augmenté en 2006 que d'environ 0,4 % par rapport ŕ 2005.
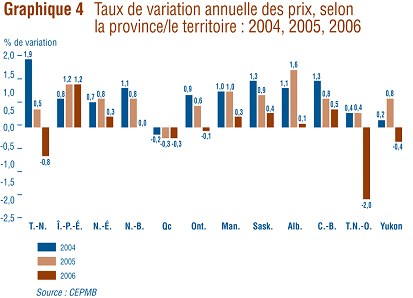
Variation des prix selon la province/le territoire
Le graphique 4 présente les taux moyens de variation des prix des médicaments brevetés selon la province ou le territoire. Les résultats ont été obtenus en appliquant la méthodologie du calcul de l'IPMB aux données sur les prix ventilées selon la province ou le territoire dans lequel les ventes ont été effectuées. En 2006, les taux moyens de variation des prix selon la province ou le territoire ont par rapport ŕ 2005 fluctué entre 1,2 % (Île-du-Prince-Édouard) et -2,0 % (Territoires du Nord-Ouest). Les augmentations moyennes des prix dans six des 13 juridictions provinciales/territoriales ont été compensées par de faibles reculs des prix en Ontario et au Québec, donnant ainsi lieu ŕ une diminution moyenne du prix national de 0,2 %.
Variation des prix selon le pays
La Loi et le Rčglemeent obligent les brevetés ŕ faire rapport au CEPMB des prix départ-usine publiquement disponibles pratiqués dans les sept pays de comparaison nommés dans le Rčglement. Ces pays sont la France, l'Allemagne, l'Italie, la Sučde, la Suisse, le Royaume-Uni et les États-Unis. Le CEPMB utilise ces données pour effectuer les comparaisons des prix internationaux prévues dans ses Lignes directrices et pour comparer les prix des médicaments pratiqués au Canada avec ceux pratiqués dans d'autres pays.
Le graphique 5 présente les taux de variation annuelle de 2006 par rapport ŕ 2005 des prix pour le Canada et pour les sept pays de comparaison nommés dans le Rčglement. Les valeurs ont été obtenues en appliquant la méthodologie de l'IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison fournis par les brevetés. On remarquera que deux résultats sont présentés pour les États-Unis : le premier résultat porte exclusivement sur les prix pratiqués aux États-Unis déclarés par les brevetés alors que le deuxičme tient aussi compte des prix de la Classification fédérale des approvisionnements (FSS). (Les prix de la Classification fédérale des approvisionnements correspondent aux prix que le Département des anciens combattants des États-Unis négocie directement avec les compagnies.)
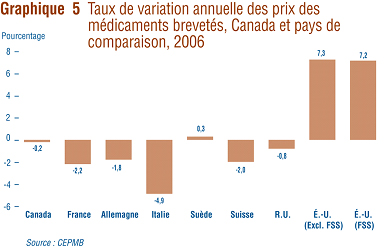
Cinq des sept pays de comparaison (exclusion faite des États-Unis et de la Sučde) ont enregistré en 2006 une baisse des prix des médicaments brevetés. De ces cinq pays, c'est l'Italie qui affiche la plus importante baisse moyenne des prix (-4,9 %).
Ŕ l'opposé, aux États-Unis les prix ont augmenté en moyenne de 7 %.
Comparaison des prix pratiqués dans les pays de comparaison avec ceux pratiqués au Canada
Le tableau 3 présente des statistiques qui permettent de comparer les prix des médicaments brevetés pratiqués dans les sept pays de comparaison avec ceux pratiqués au Canada. Le tableau présente quatre ratios de prix moyens. Ils diffčrent l'un de l'autre selon (1) la formule de calcul de la moyenne utilisée et (2) la méthode de conversion des prix exprimés dans la devise des différents pays en équivalents en dollars canadiens. Le tableau présente également le nombre de médicaments (DIN) et le volume des ventes couvertes par les statistiques.
Le CEPMB faisait jusqu'ici rapport des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada sous forme de ratios calculés ŕ l'aide d'une moyenne géométrique pondérée en fonction du volume des ventes des différents ratios. Les résultats obtenus sont présentés dans le tableau 3 (sous la rubrique Ť Moyenne géométrique ť). Le tableau présente aussi les résultats obtenus avec une moyenne arithmétique pondérée en fonction du volume des ventes (sous la rubrique Ť Moyenne arithmétique ť). Ces statistiques permettent de répondre aux questions comme la suivante : Ť Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs médicaments brevetés en 2006 s'ils les avaient achetés aux prix pratiqués dans le pays X ? ť.
Tableau 3
| Tableau 3 Ratios des prix moyens des médicaments brevetés pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, Comparaisons bilatérales, 2006 | ||||||||
| (i) Aux taux du marché |
Canada | France | Italie | Allemagne | Sučde | Suisse | R.U. | É.-U. |
| Moyenne géométrique | 1,00 | 0,87 | 0,77 | 0,99 | 0,92 | 1,06 | 1,00 | 1,68 |
| Moyenne arithmétique | 1,00 | 0,92 | 0,81 | 1,09 | 1,00 | 1,14 | 1,05 | 1,80 |
| Nombre de DIN | 1 176 | 769 | 746 | 849 | 817 | 813 | 843 | 1 014 |
| Revenus nets (millions $) | 11 989,2 | 10 004,8 | 9 855,0 | 10 226,2 | 10 122,5 | 10 427,3 | 10 640,6 | 10 898,1 |
| (ii) Aux PPA |
Canada | France | Italie | Allemagne | Sučde | Suisse | R.U. | É.-U. |
| Moyenne géométrique | 1,00 | 0,78 | 0,73 | 0,91 | 0,75 | 0,79 | 0,89 | 1,68 |
| Moyenne arithmétique | 1,00 | 0,83 | 0,77 | 1,00 | 0,81 | 0,85 | 0,94 | 1,79 |
| Nombre de DIN | 1 176 | 769 | 746 | 849 | 817 | 813 | 843 | 1 014 |
| Revenus nets (millions $) | 11 989,2 | 10 004,8 | 9 855,0 | 10 226,2 | 10 122,5 | 10 427,3 | 10 640,6 | 10 898,1 |
Par exemple, on peut voir dans le tableau 3(i) que, pour 2006, le ratio du prix moyen en France par rapport au prix moyen au Canada calculé avec la moyenne arithmétique est 0,92. Ce ratio signifie que les Canadiens auraient payé leurs médicaments brevetés 8 % de moins en 2006 s'ils avaient pu les acheter aux prix pratiqués en France.
Pendant de nombreuses années, le CEPMB a fait rapport des ratios des prix moyens pratiqués dans les pays de comparaison par rapport aux prix moyens pratiqués au Canada aprčs avoir converti les prix pratiqués dans les pays de comparaison en équivalents en dollars canadiens en utilisant pour ce faire les moyenne des taux de change (ou, plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois, taux qu'utilise généralement le CEPMB lorsqu'il applique ses Lignes directrices sur l'examen du prix). Depuis l'an dernier, le CEPMB fait rapport des ratios des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada aprčs avoir converti les devises étrangčres au moyen de la parité des pouvoirs d'achat (PPA). Le taux de parité des pouvoirs d'achat de deux pays représente le coűt de la vie relatif dans ces deux pays. En pratique, le coűt de la vie est calculé ŕ l'aide d'un panier de produits et de services aux prix courants. Étant donné que les taux de PPA représentent les niveaux de prix relatifs au coűt de la vie dans chacun des pays, ils constituent un moyen simple et fiable de rajuster les prix pour tenir compte des différences de revenus et d'autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Lorsque appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d'achat fournissent des statistiques qui nous permettent de répondre ŕ des questions comme celle-ci : Ť Dans quelle mesure les Canadiens auraient-ils dű sabrer dans leur consommation de biens et de services pour acheter des médicaments brevetés ou, encore, auraient-ils pu augmenter leur consommation de biens et de services si, en 2006, ils avaient vécu et acheté leurs médicaments brevetés dans le pays X ? ť.
D'aprčs les résultats de la conversion des différentes devises aux taux de change du marché (faite avec la moyenne géométrique), dans le tableau 3(i), les prix des médicaments brevetés pratiqués au Canada se situent dans la juste moyenne des prix pratiqués sur les différents marchés. Les prix en France et en Italie sont en général beaucoup moins élevés que les prix au Canada alors que les prix en Suisse et aux États-Unis sont plus élevés. Comme cela a été le cas dans les années antérieures, les prix des médicaments brevetés aux États-Unis sont beaucoup plus élevés que les prix pratiqués au Canada et dans les autres pays de comparaison.
Selon les résultats obtenus avec la PPA et les moyennes géométriques, les Canadiens auraient sacrifié une moins grande partie de leur budget de consommation ŕ l'achat de médicaments brevetés s'ils avaient vécu dans un des pays de comparaison, exception faite des États-Unis.
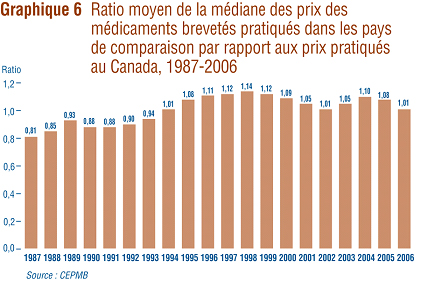
Comparaisons multilatérales des prix
Sous l'angle des résultats obtenus avec les taux de change du marché (calculés ŕ l'aide de la moyenne géométrique), le ratio de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s'est maintenu ŕ 1,01 en 2006, ce qui représente un recul marqué de la valeur enregistrée pour 2005 (1,08). Le graphique 6 présente ce résultat dans une perspective historique. En 1987, les médianes des prix pratiqués dans les pays de comparaison étaient en moyenne de 19 % inférieures aux prix canadiens. En 1998, elles dépassaient les prix canadiens de 14 %. Pour toute la décennie, le ratio moyen de la médiane des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada s'est maintenu au-dessus de la parité. Ceci étant dit, les prix pratiqués au Canada continuent d'ętre sous la médiane des prix internationaux.
Utilisation des médicaments brevetés
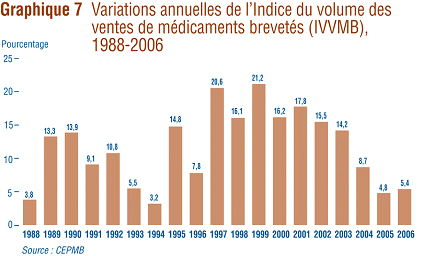
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l'IPMB servent également ŕ déterminer les tendances des quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule ŕ cette fin l'Indice du volume des ventes de médicaments brevetés (IVVMB). Le graphique 7 présente pour les années 1988 ŕ 2006 les taux moyens de croissance de l'utilisation des médicaments brevetés, mesurée ŕ l'aide de l'IVVMB. Les résultats obtenus confirment que la croissance de l'utilisation faite des médicaments brevetés est le principal facteur d'augmentation de la valeur des ventes. Cette tendance s'est maintenue en 2006 avec une augmentation de 5,4 % du taux d'utilisation des médicaments brevetés.
Ventes de médicaments au Canada par rapport aux ventes dans d'autres pays
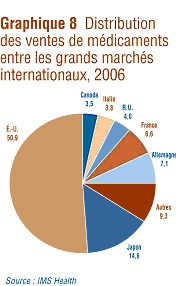
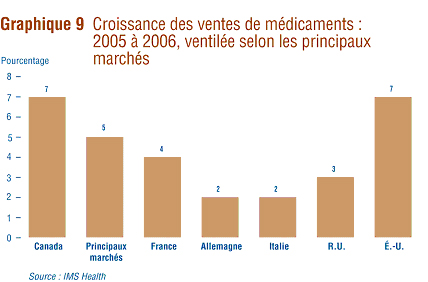
IMS Health fait réguličrement rapport des ventes des fabricants au secteur du détail dans différents pays. Selon IMS Health, ces ventes sur les principaux marchés ont totalisé 440,3 milliards de dollars en 2006.16 Le graphique 8 présente la répartition de ce montant entre les marchés. En ce qui concerne le Canada, ses ventes de médicaments ont représenté 3,5 % de l'ensemble des ventes sur les principaux marchés mondiaux. Le marché des États-Unis est de loin le plus important marché au monde.
Le graphique 9 présente les taux de croissance des ventes sur les différents marchés mondiaux pour 2005 et 2006. Selon les données de IMS Health, la croissance des ventes au Canada (7 %) a été égale ŕ celle observée aux États-Unis et supérieure ŕ celle observée dans tous les autres pays de comparaison.
Analyse des dépenses de recherche-développement
En contrepartie de l'adoption en 1987 des modifications ŕ la Loi sur les brevets, les Compagnies de recherche pharmaceutique du Canada (Rx&D) se sont engagées pour le compte de l'industrie des médicaments de marque ŕ investir dans la recherche-développement (R-D) au Canada au moins 10 % de la valeur des recettes tirées de leurs ventes et ce, ŕ compter de l'année 1996.17 En application de la Loi, le CEPMB comptabilise les dépenses annuelles des brevetés dans la R-D et en fait rapport. Le CEPMB n'a toutefois pas droit de regard sur le type de recherche-développement effectuée ni sur les sommes investies dans la R-D par les brevetés.
La Loi oblige les brevetés ŕ faire rapport au CEPMB des recettes qu'ils tirent des ventes de leurs médicaments, y compris des recettes tirées des ventes de médicaments non brevetés et des recettes découlant d'ententes de production sous licence. Ils doivent également faire rapport des dépenses de R-D qu'ils engagent au Canada pour leurs différents médicaments. Le Rčglement sur les médicaments brevetés, 1994 (Rčglement) exige qu'un fondé de pouvoir de la société pharmaceutique certifie l'exactitude de l'information fournie au Conseil. Le CEPMB ne vérifie pas systématiquement l'information qui lui est présentée, mais cherche plutôt les anomalies ou les contradictions et, s'il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour confirmer que les données qu'il a soumises ont été bien interprétées, chaque breveté est invité ŕ confirmer, avant la publication du rapport annuel, l'exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes calculé par le CEPMB. Les sociétés pharmaceutiques qui n'ont fait aucune vente de médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D. Ainsi, alors que de nouveaux brevets sont attribués et que d'autres arrivent ŕ échéance, la liste des sociétés pharmaceutiques ayant soumis un rapport sur leurs dépenses de R-D varie d'année en année.
Pour 2006, 72 sociétés pharmaceutiques vendant des médicaments brevetés pour usage humain ou pour usage vétérinaire ont présenté des rapports sur leurs dépenses de recherche-développement. De ce nombre, 28 étaient membres de Rx&D.
Recettes tirées des ventes
Pour des fins de rapport, les recettes tirées des ventes s'entendent des recettes tirées des ventes de médicaments au Canada ainsi que des recettes découlant d'ententes de vente sous licence.
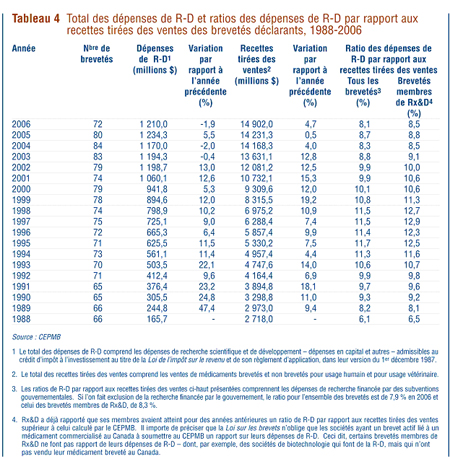
Comme l'illustre le tableau 4, la valeur des recettes tirées des ventes de médicaments au Canada déclarées par les brevetés a totalisé 14,9 milliards de dollars en 2006, plus précisément 4,7 % de plus qu'en 2005. Les recettes tirées des ventes déclarées par les brevetés membres de Rx&D ont totalisé 11,1 milliards de dollars sur la męme période, ce qui représente 75 % du total des recettes tirées des ventes. De ce montant, moins de 1 % des recettes découlent d'ententes de vente sous licence.
Dépenses de R-D
Comme le montre le tableau 4, la valeur des dépenses de R-D déclarées par l'ensemble des brevetés a totalisé 1,2 milliard de dollars en 2006, soit une baisse de 1,9 % depuis 2005. Les dépenses de R-D déclarées par les brevetés membres de Rx&D ont totalisé 949 millions de dollars en 2006, ce qui représente 78,4 % du total des dépenses déclarées ainsi qu'une diminution de 8,7 % par rapport ŕ 2005.
Ŕ titre de comparaison, les brevetés non membres de Rx&D ont déclaré des dépenses de R-D de 261 millions de dollars en 2006, soit 34,5 % de plus qu'en 2005.
Ratios des dépenses de R-D par rapport aux recettes tirées des ventes
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés est de 8,1 % pour 2006 alors qu'il était de 8,7 % en 2005. Quant au ratio des dépenses de R-D des brevetés membres de Rx&D, il est passé de 8,8 % qu'il était en 2005 ŕ 8,5 % en 2006. Les ratios des dépenses de R-D par rapport aux recettes tirées des ventes pour tous les brevetés et pour les brevetés membres de Rx&D ont baissé d'une façon assez marquée au cours des derničres années aprčs avoir atteint un sommet ŕ la fin des années 1990. C'est la sixičme fois en autant d'années que le ratio des dépenses de R-D par rapport aux recettes tirées des ventes est inférieur ŕ 10 % et la quatričme année oů les brevetés membres de Rx&D n'ont pas respecté leur engagement.
Le contexte mondial
Le graphique 10 compare pour les années 2000 et 2004 les ratios des dépenses de R-D par rapport aux recettes tirées des ventes au Canada aux męmes ratios des sept pays de comparaison. Comme le montre le graphique 10, le ratio du Canada était de 10,1 % en 2000. Cette année-lŕ, seule l'Italie présentait un ratio plus bas (6,2 %). La Suisse présentait le ratio d'investissements dans la R-D par rapport aux recettes tirées des ventes le plus élevé (102,5 %), suivie de la Sučde (44,4 %). La France, l'Allemagne et les États-Unis ont affiché des ratios variant entre 16 et 18 % tandis que le Royaume-Uni présentait un ratio deux fois plus élevé (35,1 %). Une tendance trčs semblable a été observée pour 2004. L'Italie présentait alors le ratio le moins élevé (6,6 %), suivi du Canada (8,3 %). Les ratios de tous les autres pays de comparaison étaient cette année-lŕ également de beaucoup supérieurs ŕ notre ratio, męme s'ils avaient baissé en Suisse, en Sučde et au Royaume-Uni.
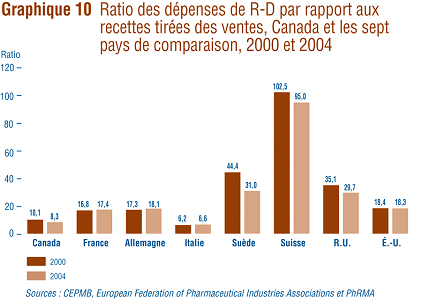
Analyses des tendances des prix des médicaments
Systčme national d'information sur l'utilisatiaon des médicaments prescrits
Le Systčme national d'information sur l'utilisation des médicaments prescrits (SNIUMP) a pour mandat de préparer des analyses critiques sur les tendances des prix des médicaments d'ordonnance, sur l'utilisation qui en est faite et sur les coűts engagés pour l'achat de médicaments. Ces analyses fournissent au régime de santé canadien une mine de renseignements sur l'utilisation faite des médicaments d'ordonnance et sur les facteurs d'augmentation des coűts. L'Institut canadien d'information sur la santé (ICIS) et le CEPMB y travaillent en partenariat. Un comité directeur formé de représentants de Santé Canada et des différents régimes publics d'assurance-médiocaments a été constitué pour conseiller l'ICIS et le CEPMB en matičre d'établissement des bases de données du SNIUMP et d'analyses. Le mandat du SNIUMP compte les deux volets suivants :
-
l'élaboration et la mise en oeuvre d'une base de données sur les ordonnanes dans laquelle seront colligées les données des différents régimes publics d'assurance-médicaments
-
la production d'analyses utilisant les renseignements versés dans la base de données.
L'ICIS est responsable du premier volet de ce mandat tandis que le CEPMB s'occupe du second comme le ministre de la Santé lui a demandé de faire en vertu de l'article 90 de la Loi sur les brevets.
Le CEPMB a effectué des analyses des tendances des prix des médicaments observées entre 1997-1998 et 2004-2005. Pour ces analyses, il a utilisé les données sur les médicaments distribués sous ordonnance colligées au niveau du DIN fournies par les huit régimes publics d'assurance-médicaments du pays.
Deux documents ont récemment été publiés pour éclairer le processus de prise de décisions :
-
Lignes directrices pour l'analyse de l'incidence du prix d'un médicament sur les budgets des régimes publics d'assurance-médicaments. Ces Lignes directrices présentent la méthodologie d'analyse de l'incidence du prix d'un médicament sur les budgets d'assurance-médicaments ainsi que les normes relatives aux rapports qui doivent ętre soumis au Programme commun d'examen des médicaments administré par l'Agence canadienne des médicaments et des technologies en santé (ACMTS) ou, encore, aux régimes d'assurance-médicaments fédéraux, provinciaux et territoriaux participant au Programme commun d'examen des médicaments (PCEM).
-
L'Observateur des médicaments émergents (OMÉ). Cette publication présente un sommaire de l'information sur les nouveaux médicaments rendus aux derničres phases de la recherche et susceptibles d'avoir une incidence assez marquée sur le plan de la valeur thérapeutique. Les prochaines livraisons de cette nouvelle publication électronique traiteront du développement clinique de médicaments émergents et de leur potentiel. Elles traiteront également des analyses du marché afin d'informer les décideurs de l'incidence que pourraient avoir ces médicaments sur les budgets des régimes d'assurance-médicaments.
Vous trouverez ces études sur notre site Web ainsi que la liste des études en cours.
Suivi des prix des médicaments non brevetés distribués sous ordonnance et rapport des tendances observées
En octobre 2005, les ministres fédéral, provinciaux et territoriaux de la Santé ont annoncé qu'ils avaient convenu de demander au CEPMB de faire un suivi des prix des médicamnets non brevetés distribués sous ordonnance. Ainsi, en novembre 2005, le CEPMB a été chargé par le ministre fédéral de la Santé de faire le suivi des prix de ces médicaments et de faire rapport de ses observations.
En 2006-2007, le CEPMB a publié trois rapports au titre de ce mandat :
-
Tendances des prix pratiqués au Canada et dans les pays de comparaison. Ce rapport, publié en juillet 2006, s'est intéressé aux tendances des prix et de la valeur des ventes au Canada et dans les pays de comparaison des médicaments non brevetés distribués sous ordonnance.
-
Tendances de la valeur des ventes au Canada et structure du marché. Ce rapport, publié en octobre 2006, analyse les taux de croissance annuelle des ventes, les sources de cette croissance, les parts de marché, la concentration des ventes et les comparaisons des prix pratiqués dans les différents pays selon leur niveau de concentration.
-
Marché des médicaments dont le brevet est récemment arrivé ŕ échéance. Ce rapport, publié en juin 2007, note les développements observés sur le marché des médicaments non brevetés dans les années suivant immédiatement l'arrivée ŕ échéance des brevets.
Ces rapports sont affichés sur notre site Web sous Ť Mandat de rapport; Suivi et rapport des prix des médicaments d'ordonnance non brevetés ť.
Un prochain rapport sur les tendances des prix des médicaments non brevetés distribués sous ordonannce au Canada et dans d'autres pays par une source exclusive.
SECTION III - RENSEIGNEMENTS SUPPLÉMENTAIRES
Organigramme
Le Conseil est formé d'au plus cinq membres siégeant ŕ temps partiel, dont un président et un vice-président. Les membres du Conseil sont nommés par le gouverneur en conseil. En vertu de la Loi sur les brevets, le président du Conseil assume également les fonctions de chef de la direction du CEPMB et, ŕ ce titre, assure la supervision et la direction des activités du Conseil. Une directrice exécutive supervise le travail du personnel. Outre la directrice exécutive, les cadres supérieurs du CEPMB sont la directrice de la conformité et de l'application, le directeur des politiques et de l'analyse économique, le directeur des services intégrés, la secrétaire du Conseil et la conseillčre juridique principale.
C'est la direction Conformité et Application qui, essentiellement, effectue l'examen des prix des médicaments brevetés et qui veille au respect de la Politique de conformité et d'application. La direction Politiques et analyse économique effectue pour sa part les analyses et prépare les rapports sur les tendances des prix ainsi que des études de nature politique et économique. Enfin, le Secrétariat, la Direction des services intégrés et la conseillčre juridique principale s'occupent de fournir le soutien nécessaire aux activités de réglementation et de rapports, en matičre de communications, d'aministration et d'avis juridiques.
Tableau financier 1 : Comparaison des dépenses prévues et des dépenses réelles (incluant les ÉTP)
| (en milliers de dollars) | 2004-2005 Dépenses réelles | 2005-2006 Dépenses réelles | 2006-2007 | |||
| Budget principal | Dépenses prévues | Total des autorisations | Total des dépenses réelles | |||
| Conseil d'examen du prix des médicaments brevetés | 4 996,7 | 5 326,5 | 6 512,0 | 6 512,0 | 11 690,0 | 7 365,3 |
| Total | 4 996,7 | 5 326,5 | 6 512,0 | 6 512,0 | 11 690,0 | 7 365,3 |
| Moins : revenus non disponibles(1) | (3 026,1) | (1 413,3) | - | - | - | (210,0) |
| Plus : Coűt des services reçus ŕ titre gracieux | 825,9 | 791,6 | 871,2 | 871,2 | 871,2 | 807,9 |
| Total des dépenses ministérielles | 2 796,5 | 4 704,8 | 7 383,2 | 7 383,2 | 12 561,2 | 7 963,2 |
|
|
||||||
| Équivalents temps plein | 42 | 42 | 48 | 48 | 63 | 43 |
(1) Les sommes comptabilisées dans les recettes non disponibles ne représentent pas les recettes générées par le CEPMB. Ce sont plutôt les sommes que les brevetés ont remises au gouvernement du Canada en application des modalités d'un engagement de conformité volontaire ou d'une ordonnance du Conseil aux fins du remboursement des recettes excédentaires encaissées. Le ministre est habilité ŕ conclure des ententes avec les provinces concernant la distribution aux provinces des sommes versées par les brevetés au Receveur général moins les coűts engagés pour leur perception et pour leur distribution.
Tableau financier 2 : Ressources par activité de programme
| 2006-2007 | ||||||
| Activité de programme | Budgétaire | Plus : Non budgétaire | Total | |||
| Fonctionnement | Total : Dépenses budgétaires brutes | Moins : Revenus disponibles | Total : Dépenses budgétaires nettes | Pręts, investissements et avances | ||
| Conseil d’examen du prix des médicaments brevetés | ||||||
| Budget principal | 6 512,0 | 6 512,0 | - | 6 512,0 | - | 6 512,0 |
| Dépenses prévues | 6 512,0 | 6 512,0 | - | 6 512,0 | - | 6 512,0 |
| Total des autorisations | 11 690,0 | 11 690,0 | - | 11 690,0 | - | 11 690,0 |
| Dépenses réelles | 7 365,3 | 7 365,3 | - | 7 365,3 | - | 7 365,3 |
Tableau financier 3 : Postes votés et législatifs
| Poste voté ou législatif | Libellé tronqué du poste voté ou législatif | 2006-2007 | |||
| Budget principal | Dépenses prévues | Total des autorisations | Dépenses réelles | ||
| 25 | Dépenses de fonctionnement | 5 800,0 | 5 800,0 | 10 978,0 | 6 742,5 |
| (L) | Contributions aux régimes d'avantages sociaux des employés | 712,0 | 712,0 | 712,0 | 622,8 |
| Total | 6 512,0 | 6 512,0 | 11 690,0 | 7 365,3 | |
Tableau financier 4 : Services reçus ŕ titre gracieux
| (en milliers de dollars) | 2006-2007 |
| Locaux fournis par Travaux publics et Services gouvernementaux Canada (TPSGC) | 489,9 |
| Contributions de l'employeur aux primes du régime d'assurance des employés et dépenses payées par le SCT (ŕ l'exceptions des fonds renouvelables) | 299,7 |
| Traitement et dépenses associées pour les services juridiques fournis par Justice Canada | 18,3 |
| Total des services reçus ŕ titre gracieux en 2006-2007 | 807,9 |
Tableau financier 5 : Sources des revenus non disponibles
| (en milliers de dollars) | 2004-2005 Dépenses réelles | 2005-2006 Dépenses réelles | 2006-2007 | |||
| Budget principal | Dépenses prévues | Total des autorisations | Dépenses réelles | |||
| Conseil d'examen du prix des médicaments brevetés | ||||||
| Source des revenus non disponibles (1) | ||||||
| Engagements de conformité volontaire | 3 026,1 | 1 413,3 | - | - | - | 210,0 |
| Total des revenus non disponibles | 3 026,1 | 1 413,3 | - | - | - | 210,0 |
(1) Les sommes comptabilisées dans les recettes non disponibles ne représentent pas les recettes générées par le CEPMB. Ce sont plutôt les sommes que les brevetés ont remises au gouvernement du Canada en application des modalités d'un engagement de conformité volontaire ou d'une ordonnance du Conseil aux fins du remboursement des recettes excessives encaissées de la vente d'un médicament ŕ des prix excessifs. Le ministre est habilité ŕ conclure des ententes avec les provinces concernant la distribution aux provinces des sommes versées par les brevetés au Receveur général moins les coűts engagés pour leur perception et pour leur distribution.
Tableau financier 6 : États financiers du Conseil d'examen du prix des médicaments brevetés
Déclaration de responsabilité de la direction
La responsabilité de l'intégrité et de l'objectivité des états financiers ci-joints pour l'exercice terminé le 31 mars 2007 et toute l'information figurant dans ces états incombe ŕ la direction du Conseil. Ces états financiers ont été préparés par la direction conformément aux conventions comptables du Conseil du Trésor, qui sont conformes aux principes comptables généralement reconnus du Canada pour le secteur public.
La direction est responsable de l'intégrité et de l'objectivité de l'information présentée dans les états financiers. Certaines informations présentées dans les états financiers sont fondées sur les meilleures estimations et le jugement de la direction et tiennent compte de l'importance relative. Pour s'acquitter de ses obligations au chapitre de la comptabilité et de la présentation des rapports, la direction tient des comptes qui permettent l'enregistrement centralisé des opérations financičres du ministčre. L'information financičre soumise pour la préparation des Comptes publics du Canada et incluse dans le Rapport ministériel sur le rendement du conseil concorde avec les états financiers ci-joints.
La direction possčde un systčme de gestion financičre et de contrôle interne conçu pour fournir une assurance raisonnable que l'information financičre est fiable, que les actifs sont protégés et que les opérations sont conformes ŕ la Loi sur la gestion des finances publiques , qu'elles sont exécutées en conformité avec les rčglements, qu'elles respectent les autorisations du Parlement et qu'elles sont comptabilisées de maničre ŕ rendre compte de l'utilisation des fonds du gouvernement. La direction veille également ŕ l'objectivité et ŕ l'intégrité des données de ses états financiers par la sélection appropriée, la formation et le perfectionnement d'employés qualifiés, par une organisation assurant une séparation appropriée des responsabilités et par des programmes de communication visant ŕ assurer la compréhension des rčglements, des politiques, des normes et des responsabilités de gestion dans tout le Conseil.
Les états financiers du Conseil n'ont pas fait l'objet d'une vérification.
 |
|
| Brien G. Benoit, M.D. Président Conseil d'examen du prix des médicaments brevetés 6 septembre 2007 |
Barbara Ouellet Directrice éxécutive, CEPMB Conseil d'examen du prix des médicaments brevetés 30 aoűt 2007 |
État des résultats (non vérifié)
| Exercice terminé le 31 mars | 2007 | 2006 |
| (en dollars) | ||
| Dépenses | ||
| Salaires et avantages sociaux | 4 815 847 | 4 084 405 |
| Services professionnels et spéciaux | 1 951 204 | 871 998 |
| Installations | 489 894 | 582 600 |
| Services publics' fournitures et approvisionnements | 484 531 | 247 009 |
| Voyage et réinstallation | 181 186 | 85 756 |
| Achat de services de réparation et d'entretien | 124 330 | 70 340 |
| Information | 122 086 | 55 496 |
| Communications | 83 510 | 76 516 |
| Location | 16 014 | 10 133 |
| Amortissement | 3 101 | 3 383 |
| Autres | 55 634 | 118 942 |
| 8 327 337 | 6 206 578 | |
| Revenus | ||
| Engagement de conformité volontaire | 210 043 | 1 413 415 |
| Coűt de fonctionnement net | 8 117 294 | 4 793 163 |
| Les notes complémentaires font partie intégrante des états financiers | ||
État de la situation financičre (non vérifié)
| au 31 mars | 2007 | 2006 |
| (en dollars) | ||
| Actifs | ||
| Actifs financiers Débiteurs et avances (Note 4) |
108 595 |
35 819 |
| 108 595 | 35 819 | |
| Actifs non financiers Immobilisations corporelles (Note 5) |
- |
3 101 |
| - | 3 101 | |
| 108 595 | 38 920 | |
| Passifs et avoir du Canada | ||
| Passifs Créditeurs et charges ŕ payer Indemnités de vacance et congés compensatoires (Note 6) Indemnités de départ (Note 7) |
784 600 266 437 733 660 |
453 184 200 419 645 076 |
| 1 784 697 | 1 298 679 | |
| Avoir du Canada | (1 676 102) | (1 259 759) |
| 108 595 | 38 920 | |
| Les notes complémentaires font partie intégrante des états financiers | ||
État de l'avoir du Canada (non vérifié)
| au 31 mars | 2007 | 2006 |
| (en dollars) | ||
| Avoir du Canada, début de l'exercice | (1 259 759) | ( 680 523) |
| Coűt de fonctionnement net | (8 117 294) | (4 793 163) |
| Crédits de l'exercice en cours utilisés (Note 3) | 7 365 303 | 5 326 472 |
| Revenus non disponibles pour dépenser | ( 218 605) | (1 413 557) |
| Variation de la situation nette du Trésor (Note 3) | ( 253 685) | ( 490 541) |
| Services fournis gratuitement par d'autres ministčres (Note 8) | 807 938 | 791 553 |
| Avoir du Canada, fin de l'exercice | (1 676 102) | (1 259 759) |
| Les notes complémentaires font partie intégrante des états financiers | ||
État des flux de trésorerie (non vérifié)
| Exercice terminé le 31 mars | 2007 | 2006 |
| (en dollars) | ||
| Activités de fonctionnement | ||
| Coűt de fonctionnement net | 8 117 294 | 4 793 163 |
| Éléments n'affectant pas l'encaisse : Amortissement des immobilisations corporelles (Note 5) Services fournis gratuitement par d'autres ministčres (Note 8) |
( 3 101) ( 807 938) |
( 3 383) ( 791 553) |
| Variations de l'état de la situation financičre : Augmentation (diminution) des débiteurs et avances Diminution (augmentation) du passif |
72 776 ( 486 018) |
( 589 360) 13 507 |
| Encaisse utilisée par les activités de fonctionnement | 6 893 013 | 3 422 374 |
| Activités de financement | ||
| Encaisse nette fournie par le gouvernement du Canada | (6 893 013) | (3 422 374) |
| Les notes complémentaires font partie intégrante des états financiers | ||
Notes complémentaires aux états financiers (non vérifiées)
1. Mandat et objectifs
Le Conseil d´examen du prix des médicaments brevetés (CEPMB) est un organisme indépendant qui détient des pouvoirs quasi-judiciaires. Il a été créé par le Parlement en 1987 en vertu de la Loi sur les brevets.
Męme s´il fait techniquement partie du portefeuille de la Santé, le CEPMB exerce son mandat en toute indépendance du Ministre de la Santé. Il fonctionne d´une façon indépendante des autres organismes, dont Santé Canada, qui vérifie l´innocuité et l´efficacité des médicaments, et les régimes d'assurance-médicaments qui en approuvent l'inscription sur leurs formulaires respectifs des médicaments admissibles ŕ un remboursement.
Le CEPMB est investi d´un double rôle :
- Réglementation : Exercer un contrôle sur les prix départ-usine des médicaments brevetés vendus au Canada afin qu'ils ne soient pas excessifs, protégeant ainsi les consommateurs et contribuant au régime de santé canadien.
- Rapports : Établir des rapports sur les tendances des prix des médicaments et sur les dépenses que les brevetés engagent dans la R-D, éclairant ainsi le processus décisionnel et d´élaboration des politiques.
Compétence du CEPMB :
Réglementation - Le CEPMB passe en revue les prix départ-usine, ŕ savoir les prix auxquels les brevetés vendent leurs médicaments pour usage humain ou vétérinaire distribués au Canada sous ordonnance ou en vente libre aux grossistes, aux hôpitaux et aux pharmacies pour que ces prix ne soient pas excessifs. Le CEPMB exerce un contrôle sur le prix de chaque médicament breveté, soit de chaque concentration de chaque forme posologique de chaque médicament breveté offert sur le marché canadien. C´est habituellement ŕ ce niveau que Santé Canada attribue le numéro d´identification de drogue (DIN).
Le CEPMB n´est pas habilité ŕ exercer un contrôle sur les prix des médicaments non brevetés, incluant les médicaments génériques vendus en vertu de licences obligatoires. Il n´a non plus aucun droit de regard sur les prix de vente au gros et au détail ni sur les honoraires des pharmaciens. La distribution et l´ordonnance des médicaments ne relčvent pas non plus de la compétence du CEPMB.
Rapports - Le CEPMB rend annuellement compte de ses activités au Parlement par le truchement du ministre de la Santé. Le rapport annuel, qui porte sur une année civile, passe en revue les principales activités du CEPMB, analyse les prix des médicaments brevetés et les tendances des prix de tous les médicaments, et fait rapport des dépenses de R-D déclarées par les titulaires de brevets pharmaceutiques.
2. Sommaire des principales conventions comptables
Les états financiers ont été préparés conformément aux conventions comptables du Conseil du Trésor, qui sont conformes aux principes comptables généralement reconnus du Canada pour le secteur public.
Les principales conventions comptables sont les suivantes :
(a) Crédits parlementaires
Le Conseil est financé par le gouvernement du Canada au moyen de crédits parlementaires. Les crédits consentis au Conseil ne correspondent pas ŕ la présentation des rapports financiers en conformité avec les principes comptables généralement reconnus étant donné que les crédits sont fondés, dans une large mesure, sur les besoins de trésorerie. Par conséquent, les postes comptabilisés dans l'état des résultats et dans l'état de la situation financičre ne sont pas nécessairement les męmes que ceux qui sont prévus par les crédits parlementaires. La note 3 présente un rapprochement général entre les deux méthodes de rapports financiers.
(b) Encaisse nette fournie par le gouvernement
Le Conseil fonctionne au moyen du Trésor, qui est administré par le receveur général du Canada. La totalité de l'encaisse reçue par le Conseil est déposée au Trésor, et tous les décaissements faits par le Conseil sont prélevés sur le Trésor. L'encaisse nette fournie par le gouvernement est la différence entre toutes les rentrées de fonds et toutes les sorties de fonds, y compris les opérations entre les ministčres au sein du gouvernement fédéral.
(c) Variation de la situation nette du Trésor
La variation de la situation nette du Trésor correspond ŕ la différence entre l'encaisse nette fournie par le gouvernement et les crédits utilisés au cours d'un exercice, ŕ l'exclusion du montant des revenus non disponibles comptabilisés par le Conseil. Il découle d'écarts temporaires entre le moment oů une opération touche un crédit et le moment oů elle est traitée par le Trésor (Voir la note 3 (c) pour un rapprochement de l'encaisse nette fournie par le gouvernement et des crédits de l'exercice en cours utilisés).
(d) Revenues
Les revenus sont comptabilisés dans la période oů les faits sous-jacents surviennent. Les revenus de CEPMB représentent des sommes comptabilisées dans les recettes non disponibles ne représentent pas des recettes générées par le CEPMB. Ce sont plutôt les sommes que les brevetés ont remises au gouvernement du Canada en application des modalités d'un engagement de conformité volontaire ou d'une ordonnance du Conseil aux fins du remboursement des recettes excédentaires encaissées.
(e) Charges
Les charges sont comptabilisées selon la méthode de la comptabilité d'exercice :
- Les indemnités de vacances et de congés compensatoires sont passées en charges au fur et ŕ mesure que les employés en acquičrent le droit en vertu de leurs conditions d'emploi respectives.
- Les services fournis gratuitement par d'autres ministčres pour les locaux et les cotisations de l'employeur aux régimes de soins de santé et de soins dentaires sont comptabilisés ŕ titre de charges de fonctionnement ŕ leur coűt estimatif.
(f) Avantages sociaux futurs
- Prestations de retraite : Les employés admissibles participent au Régime de retraite de la fonction publique, un régime multi-employeurs administré par le gouvernement du Canada. Les cotisations du Conseil au régime sont passées en charges dans l'exercice au cours duquel elles sont engagées et elles représentent l'obligation totale du découlant du régime. En vertu des dispositions législatives en vigueur, le Conseil n'est pas tenu de verser des cotisations au titre de l'insuffisance actuarielle du régime.
- Indemnités de départ : Les employés ont droit ŕ des indemnités de départ, prévues dans leurs conventions collectives ou les conditions d'emploi. Le coűt de ces indemnités s'accumule ŕ mesure que les employés effectuent les services nécessaires pour les gagner. Le coűt des avantages sociaux gagnés par les employés est calculé ŕ l'aide de l'information provenant des résultats du passif déterminé sur une base actuarielle pour les prestations de départ pour l'ensemble du gouvernement.
(g) Débiteurs et avances
Les débiteurs sont comptabilisés en fonction des montants que l'on prévoit réaliser. Ils comprennent principalement des montants a ętre recouverts de d'autres ministčres gouvernementaux dont le recouvrement est considéré certain. Par conséquent, aucune provision n'a été établie en contrepartie de ces sommes.
(h) Immobilisations corporelles
Toutes les immobilisations corporelles avec une valeur initiale de 10 000 $ ou plus sont enregistrées utilisant le coűt d’acquisition. Le Conseil ne capitalise pas les biens incorporels, les oeuvres d’arts et les trésors historiques ayant une valeur culturelle, esthétique ou historique.
L’amortissement des immobilisations se fait selon une base linéaire sur l’estimé de la durée de vie utile de l’actif :
| Catégorie d'immobilisations | Période d'amortissement |
| Matériel informatique | 3-5 ans |
(i) Incertitude relative ŕ la mesure
La préparation de ces états financiers conformément aux conventions comptables du Conseil du Trésor du Canada, qui sont conformes aux principes comptables généralement reconnus du Canada pour le secteur public, exige de la direction qu'elle fasse des estimations et pose des hypothčses qui influent sur les montants déclarés des actifs, des passifs, des revenus et des charges présentés dans les états financiers. Au moment de la préparation des présents états financiers, la direction considčre que les estimations et les hypothčses sont raisonnables. Les principaux éléments pour lesquels des estimations sont faites sont le passif pour les indemnités de départ et la durée de vie utile des immobilisations corporelles . Les résultats réels pourraient différer des estimations de maničre significative. Les estimations de la direction sont examinées périodiquement et, ŕ mesure que les rajustements deviennent nécessaires, ils sont constatés dans les états financiers de l'exercice oů ils sont connus.
3. Crédits parlementaires
Le Conseil reçoit la plus grande partie de son financement au moyen de crédits parlementaires annuels. Les éléments comptabilisés dans l'état des résultats et l'état de la situation financičre d'un exercice peuvent ętre financés au moyen de crédits parlementaires qui ont été autorisés dans des exercices précédents, pendant l'exercice en cours ou qui le seront dans des exercices futurs. En conséquence, le coűt de fonctionnement net du Conseil diffčre selon qu'il est présenté selon le financement octroyé par le gouvernement ou selon la méthode de la comptabilité d'exercice. Les différences sont rapprochées dans les tableaux suivants :
| (a) Rapprochement du coűt de fonctionnement net et des crédits parlementaires de l'exercice en cours : | 2007 | 2006 |
| (en dollars) | ||
| Coűt de fonctionnement net | 8 117 294 | 4 793 163 |
| Rajustements pour les postes ayant une incidence sur le coűt de fonctionnement net, mais qui n'ont pas d'incidence sur les crédits Ajouter (déduire) : | ||
| Ajouter (déduire) : | ||
| Revenu non disponible pour dépenser | 218 605 | 1 413 557 |
| Services fournis gratuitement | ( 807 938) | ( 791 553) |
| Amortissement des immobilisations corporelles | ( 3 101) | ( 3 383) |
| Services légaux de Justice Canada | ( 4 979) | ( 7 595) |
| Provision pour congés annuels | ( 54 429) | ( 1 370) |
| Provision pour congés compensatoires | ( 11 589) | 2 315 |
| Provision pour le passif relatif aux indemnités de départ | ( 88 586) | ( 78 669) |
| Autres augmentation du passif | 26 | 7 |
| ( 751 991) | 533 309 | |
| Crédits de l'exercice en cours utilisés | 7 365 303 | 5 326 472 |
| (b) Crédits fournis et utilisés : | Crédits octroyés | |
| (en dollars) | 2007 | 2006 |
| Dépenses de fonctionnement - Crédit 25 | 10 978 025 | 5 081 000 |
| Montants législatifs | 622 760 | 543 344 |
| Moins: | ||
| Crédits annulés | (4 235 482) | ( 297 872) |
| Crédits de l'exercice en cours utilisés | 7 365 303 | 5 326 472 |
| (c) Rapprochement de l'encaisse nette fournie par le gouvernement et des crédits de l'exercice en cours utilisés | 2007 | 2006 |
| (en dollars) | ||
| Encaisse nette fournie par le gouvernement | 6 893 013 | 3 422 374 |
| Revenu non disponible pour dépenser | 218 605 | 1 413 557 |
| Variation de la situation nette du Trésor Variation des débiteurs et des avances Variation des créditeurs et des charges ŕ payer Autres ajustements |
( 72 776) 331 414 ( 4 953) |
589 361 ( 91 232) ( 7 588) |
| 253 685 | 490 541 | |
| Crédits de l'exercice en cours utilisés | 7 365 303 | 5 326 472 |
4. Débiteurs et avances
| 2007 | 2006 | |
| (en dollars) | ||
| Débiteurs des autres ministčres et organismes fédéraux | 108 095 | 35 319 |
| Avances aux employés | 500 | 500 |
| 108 595 | 35 819 | |
5. Immobilisations corporelles
| Coűt (en dollars) |
Solde d'ouverture | Acquisitions | Aliénations et radiations | Solde de clôture |
| Matériel informatique | 91 242 | - | - | 91 242 |
| 91 242 | - | - | 91 242 | |
| Amortissement cumulé (en dollars) |
Solde d'ouverture | Amortissement | Aliénations et radiations | Solde de clôture |
| Matériel informatique | 88 141 | 3 101 | - | 91 242 |
| 88 141 | 3 101 | - | 91 242 | |
| Valeur comptable nette | 3 101 | - | - | - |
| La charge d’amortissement pour l’exercice terminé le 31 mars 2007 s’élčve ŕ 3 101 $ (2006 – 3 383 $) | ||||
6. Indemnités de vacance et congés compensatoires
| (en dollars) | 2007 | 2006 |
| Provision pour indemnités de vacance | 253 100 | 198 671 |
| Provision pour congés compensatoires | 13 337 | 1 748 |
| 266 437 | 200 419 |
7. Avantages sociaux
(a) Prestations de retraite
Prestations de retraite: Les employés du Conseil participent au Régime de retraite de la fonction publique, qui est parrainé et administré par le gouvernement du Canada. Les prestations de retraite s'accumulent sur une période maximale de 35 ans au taux de 2 % par année de services validables multiplié par la moyenne des gains des cinq meilleures années consécutives. Les prestations sont intégrées aux prestations du Régime de pensions du Canada et du Régime de rentes du Québec et sont indexées ŕ l'inflation.
Tant les employés que le ministčre versent des cotisations couvrant le coűt du régime. Les charges pour l'exercice courant et pour l'exercice précédent, soit environ 2.2 fois (2.6 en 2006) les cotisations des employés, correspondent ŕ :
| (en dollars) | 2007 | 2006 |
| Charge pour l'exercice | 458 955 | 402 069 |
| 458 955 | 402 069 |
La responsabilité du Conseil relative au régime de retraite se limite aux cotisations versées. Les excédents ou les déficits actuariels sont constatés dans les états financiers du gouvernement du Canada, en sa qualité de répondant du régime.
b) Indemnités de départ
Le Conseil verse des indemnités de départ aux employés en fonction de l'admissibilité, des années de service et du salaire final. Ces indemnités ne sont pas capitalisées d'avance. Les prestations seront prélevées sur les crédits futurs. Voici quelles étaient les indemnités de départ au 31 mars :
| (en dollars) | 2007 | 2006 |
| Obligation au titre des prestations constituées, début de l'exercice | 645 076 | 566 407 |
| Charge pour l'exercice | 147 991 | 150 455 |
| Prestations versées pendant l'exercice | ( 59 407) | ( 71 786) |
| Obligation au titre des prestations constituées, fin de l'exercice | 733 660 | 645 076 |
8. Opérations entre apparentés
En vertu du principe de propriété commune, le Conseil est apparenté ŕ tous les ministčres, organismes et sociétés d'État du gouvernement du Canada. Le Conseil conclut des opérations avec ces entités dans le cours normal de ses activités et selon des modalités commerciales normales. De plus, au cours de l'exercice, le Conseil reçoit gratuitement des services d'autres ministčres, comme il est indiqué ŕ la partie (a).
(a) Services fournis gratuitement
Au cours de l'exercice, le Conseil reçoit gratuitement des services d'autres ministčres. Ces services gratuits ont été constatés comme suit dans l'état des résultats du Conseil :
| (en dollars) | 2007 | 2006 |
| Installations | 489 894 | 582 600 |
| Cotisations de l'employeur au régime de soins de santé et régime de soins dentaires | 299 709 | 197 000 |
| Justice Canada | 18 335 | 11,953 |
| 807 938 | 791 553 |
Le gouvernement a structuré certaines de ses activités administratives de maničre ŕ optimiser l'efficience et l‘efficacité de sorte qu'un seul ministčre mčne sans frais certaines activités au nom de tous. Le coűt de ces services, qui comprennent les services de paye et d'émission des chčques offerts par Travaux publics et Services gouvernementaux Canada et les services de vérification offerts par le Bureau du vérificateur général, ne sont pas inclus ŕ titre de charge dans l'état des résultats du ministčre.
(b) Soldes des créditeurs ŕ la fin de l'exercice entre apparentés :
| (en dollars) | 2007 | 2006 |
| Créditeurs - Autres ministčres et organismes gouvernementaux | 32 043 | 36 304 |
1 Conformément ŕ la décision prise par le Conseil du Trésor au cours de sa réunion du 22 juin 2006, le CEPMB a, au titre du Budget des dépenses supplémentaires (A), obtenu 4 914 625 $ aux fins de tenir des audiences publiques et de moderniser ses Lignes directrices sur les prix excessifs.
2 Conformément ŕ la décision de juin 2006 du Conseil du Trésor, le CEPMB a reçu les crédits additionnels auxquels il est fait référence dans la note de bas de page no 1. Le Conseil du Trésor a approuvé les dispositions requises pour donner au CEPMB accčs au crédit 5 au cas oů les fonds ne seraient pas suffisants jusqu'en décembre 2006. Afin d'éviter autant que possible d'avoir ŕ puiser des fonds dans le crédit 5, certaines activités associées au projet de modernisation des Lignes directrices ont été reportées (dont les rencontres de consultation avec les intervenants qui ont été reportées en novembre). Par ailleurs, alors que le nombre d'audiences prévues pour 2006-2007 a été atteint ŕ la fin de l'exercice financier, les Avis d'audience ont été émis plus tard que prévu. Enfin, en raison du temps mis ŕ doter les nouveaux postes approuvés, des travaux dans d'autres secteurs d'activités (par ex. analyses des tendances des prix des médicaments) ont dű ętre mis en veilleuse au profit de projets plus pressants. Par conséquent, la valeur totale des dépenses réelles a été moindre que la valeur autorisée.
3 Numéro d'identification que la Direction générale de la protection de la santé de Santé Canada attribue ŕ chaque médicament vendu sous ou sans ordonnance et commercialisé en vertu du Rčglement sur les aliments et drogues. Le DIN est assigné en tenant compte des éléments suivants : le fabricant du produit, le ou les ingrédients actifs, la forme posologique, le nom de marque du produit et son mode d'administration.
4 Les Lignes directrices sont publiées ŕ l'intérieur du Compendium des Lignes directrices, politiques et procédures. Ce document est disponible sur notre site Web (www.pmprb-cepmb.gc.ca) sous Ť Loi, Rčglement et Lignes directrices ť.
5 Vous trouverez dans la section 4 du Rčglement de plus amples détails sur les données que les brevetés doivent soumettre au Conseil. Le Guide du breveté fait état des quatre catégories de clients qui sont : les hôpitaux, les pharmacies, les grossistes et autres.
6 Aux fins de l'examen du prix, un nouveau médicament breveté en 2006 s'entend d'un médicament breveté lancé sur le marché canadien en 2006 ou, encore, d'un médicament ayant obtenu son premier brevet entre le 1er décembre 2005 et le 30 novembre 2006 męme s'il était disponible au Canada. La męme approche est appliquée ŕ toutes les années pour accommoder les délais de présentation des rapports en vertu du Rčglement sur les médicaments brevetés, 1994 et pour calculer les prix de référence.
7 Aux fins du présent rapport, les médicaments existants comprennent tous les médicaments brevetés lancés sur le marché canadien avant le 1er décembre 2005.
8 L'affaire de Janssen-Ortho Inc. et le prix de son médicament Risperdal Consta a été réglée au moyen d'un Engagement de conformité volontaire qui a mis fin ŕ l'audience. Vous trouverez de plus amples renseignements sur cet engagement ŕ la page 25 du présent rapport.
9 L'affaire de 3M Canada Company et du prix de son médicament Airomir a été réglée au moyen d'un Engagement de conformité volontaire qui a mis fin ŕ l'audience. Vous trouverez de plus amples renseignements sur cet engagement ŕ la page 24 présent rapport.
10 Vous trouverez le texte officiel de l'engagement de conformité volontaire sur le site Web du CEPMB (www.pmprb-cepmb.gc.ca) sous Ť Mandat de réglementation, Engagements de conformité volontaire ť.
11 Suite ŕ l'acceptation de l'Engagement de conformité volontaire soumis par 3M Canada Company dans l'affaire de son médicament Airomir ainsi que de l'Engagement de conformité volontaire soumis par Janssen-Ortho Inc. concernant son médicament Risperdal Consta, le nombre d'audiences en instance est passé de dix ŕ huit. Le 25 juillet, le Conseil a émis un autre Avis d'audience dans l'affaire Abbott Limitée, Les Laboratoires et du prix de son médicament Zemplar. Le nombre d'audiences en instance est ainsi passé ŕ neuf.
12 Vous trouverez de plus amples détails sur ce cas sous la rubrique Ť Engagements de conformité volontaire ť, ŕ la page 22.
13 Pour des raisons de confidentialité, les données relatives ŕ ces deux groupes ont été combinées.
14 Le Rčglement sur les médicaments brevetés, 1994 prévoit que les brevetés doivent fournir des données sur les ventes qu'ils font ŕ quatre catégories de clients nommées dans le Guide du breveté. Ces catégories de clients sont les hôpitaux, les pharmacies, les grossistes et autres.
15 Les résultats pour une quatričme catégorie de clients, la catégorie Ť Autres ť, ne sont pas fournis. Les acheteurs de la catégorie Ť Autres ť sont essentiellement des établissements de soins de santé autres que les hôpitaux, notamment des cliniques médicales, des centres de soins infirmiers, des cabinets de médecins, etc.
16 IMS Health Retail Drug Monitor, Décembre 2005 (www.imshealth.com). IMS Health Retail Drug Monitor présente des estimés des acahts directs (achats effectués directemetn auprčs du fabricant) et des achats indirects des pharmacies (achats effectués auprčs d'un grossiste) dans 13 pays industrialisés. Ces pays sont l'Argentine, l'Australie, le Brésil, le Canada, la France, l'Allemagne, l'Italie, le Japon, le Mexique, la Nouvelle-Zélande, l'Espagne, le Royaume-Uni et les États-Unis. Les valeurs sont exprimées aux prix du fabricant (prix départ-usine) et couvrent tous les médicaments d'ordonnance et certains médicaments en vente libre.
17 Tel que publié dans le Résumé de l'étude d'impact de la réglementation du Rčglement sur les médicaments brevetés, 1988, publié dans la Partie II de la Gazette du Canada, Vol. 122, no 20 - SOR/DORS/88-474